题目内容
1.下列对氯及其化合物的说法正确的是( )| A. | 用pH试纸能测得氯水的pH=4 | |
| B. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| C. | 所有的金属都是固态的 | |
| D. | 用平行光线照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
分析 A.氯水中的次氯酸具有漂白性;
B.胶体区别于其他分散系的本质特征是分散质的微粒直径大小;
C.常温下汞为液体;
D.胶体具有丁达尔效应,溶液无此现象.
解答 解:A.测定pH最简单的方法是使用pH试纸,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH,但氯水具有漂白性,无法与标准比色卡对照,故A错误;
B.胶体区别于其他分散系的本质特征是分散质的微粒直径大小,胶体分散系的微粒直径在1~100nm之间,故B正确;
C.不是所有的金属都是固态的,如金属汞为液体,故C错误;
D.用平行光照射NaCl溶液和Fe(OH)3胶体时,Fe(OH)3胶体中会产生光亮的通路,产生丁达尔现象,NaCl溶液无此现象,故D错误;
故选B.
点评 本题考查了胶体特征、胶体性质、溶液PH测定和次氯酸的漂白性分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
11.将1-氯丙烷跟NaOH的醇溶液共热后,生成的产物再跟溴水反应,得到的该有机物是 ( )
| A. | CH3-CH2-CHBr2 | B. |  | C. |  | D. |  |
9.水热法制备纳米化合物Y的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中不正确的是( )
| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1molO2参加反应时,转移电子的物质的量为4 mol |
16.下列各项操作中最终有沉淀生成的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中滴加少量稀H2SO4
③向BaCl2溶液中通CO2
④向石灰水中逐渐通入CO2至过量
⑤向NaHSO4溶液中逐滴滴加Ba(OH)2至过量.
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中滴加少量稀H2SO4
③向BaCl2溶液中通CO2
④向石灰水中逐渐通入CO2至过量
⑤向NaHSO4溶液中逐滴滴加Ba(OH)2至过量.
| A. | ②③⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①②④⑤ |
6.等体积等物质的量浓度的①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3混合溶液中,下列各项排序正确的是( )
| A. | pH:②>③>④>① | B. | c(CH3COO-):②>④>③>① | ||
| C. | 溶液中c(H+):①>③>②>④ | D. | c(CH3COOH):①>④>③>② |
13.下列说法正确的是( )
| A. | 钠原子与氯原子反应生成NaCl后,其结构的稳定性增强 | |
| B. | 阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距离相当小 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 任何离子键在形成的过程中必定有电子的得与失 |
10.A原子示意图为 ,则x、y及该原子3p能级上的电子数分别为( )
,则x、y及该原子3p能级上的电子数分别为( )
 ,则x、y及该原子3p能级上的电子数分别为( )
,则x、y及该原子3p能级上的电子数分别为( )| A. | 18、6、4 | B. | 22、8、6 | C. | 26、14、6 | D. | 15、3、1 |
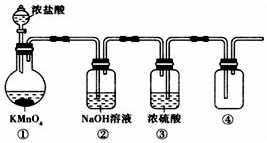 高锰酸钾(KMnO4)与浓盐酸不需加热就能发生反应产生Cl2.若用如图所示的实验装置制备纯净、干燥的Cl2,其中有错误的装置是( )
高锰酸钾(KMnO4)与浓盐酸不需加热就能发生反应产生Cl2.若用如图所示的实验装置制备纯净、干燥的Cl2,其中有错误的装置是( )