题目内容
每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要.钢铁防腐方法有许多种,图-1与图-2是两个典型的例子.对其中原理的描述正确的是( )
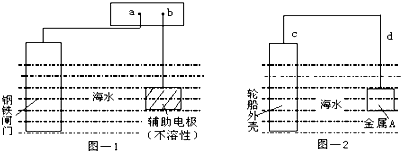

| A、图-1:a为电源正极 |
| B、图-1:辅助电极上发生氧化反应 |
| C、图-2:电流方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:作原电池负极或电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护,原电池放电时,电子从负极沿导线流向正极,电流方向与此相反,据此分析解答.
解答:
解:A.图-1为电解池,要保护钢铁,则钢铁应该作电解池阴极,所以a为电源负极,故A错误;
B.图-1为电解池,要保护钢铁,则钢铁应该作电解池阴极,辅助电极为阳极,阳极上失电子发生氧化反应,故B正确;
C.图-2为原电池,要保护轮船外壳,则轮船外壳作正极,金属A作负极,电流方向由正极c流向负极d,故C错误;
D.图-2为原电池,要保护轮船外壳,则轮船外壳作正极,金属A作负极,所以A的活泼性大于Fe,则金属A不能是耐腐蚀的金属铜,可以是Zn,故D错误;
故选B.
B.图-1为电解池,要保护钢铁,则钢铁应该作电解池阴极,辅助电极为阳极,阳极上失电子发生氧化反应,故B正确;
C.图-2为原电池,要保护轮船外壳,则轮船外壳作正极,金属A作负极,电流方向由正极c流向负极d,故C错误;
D.图-2为原电池,要保护轮船外壳,则轮船外壳作正极,金属A作负极,所以A的活泼性大于Fe,则金属A不能是耐腐蚀的金属铜,可以是Zn,故D错误;
故选B.
点评:本题考查金属的腐蚀与防护,明确金属腐蚀快慢顺序“作电解池阳极>作原电池负极>化学腐蚀>作电解池正极>作原电池阴极”即可解答,题目难度不大.

练习册系列答案
相关题目
能正确描述氮原子或氮分子的化学用语是( )
A、 |
| B、1s22s22p5 |
| C、:N≡N: |
D、 |
在一定温度下,可以表示可逆反应从A(g)+3B(g)?2(C)达到平衡的标志是( )
①C生成的速率与C分解的速率相等
②单位时间生成nmolA,同时生成3nmolB
③A、B、C的浓度不再变化
④A、B、C的分子数之比为1:3:2.
①C生成的速率与C分解的速率相等
②单位时间生成nmolA,同时生成3nmolB
③A、B、C的浓度不再变化
④A、B、C的分子数之比为1:3:2.
| A、①② | B、①④ | C、①③ | D、②③ |
铍原子比铝原子少1个电子层,最外层电子数也比铝原子少1,在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.下列关于铍的判断不正确的是( )
| A、Be能在空气中燃烧 |
| B、BeO熔点较低 |
| C、BeCl2是共价化合物 |
| D、Be(OH)2具有两性 |
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、样品中CuO的质量为4.0g |
| C、V=448 |
| D、原样品中Fe元素的质量分数为41% |
下列物质不能通过化合反应直接得到的是( )
| A、FeCl2 |
| B、Fe(OH)3 |
| C、CuS |
| D、NaHCO3 |
下列说法中错误的是( )
| A、氨气极易溶于水,可做喷泉实验 |
| B、硅是制造太阳能电池的常用材料 |
| C、NO2与水反应,它既是氧化剂又是还原剂 |
| D、用铁与稀硝酸反应来制备氢气 |
在一定条件下,反应N2+3H2?2NH3,在1L密闭容器中进行,5min内氨的质量增加了17g,则反应速率为
( )
( )
| A、V (H2)=0.03mol/(L?min) |
| B、V(N2)=0.2mol/(L?min) |
| C、V (NH3)=0.02mol/(L?min) |
| D、V (NH3)=0.2mol/(L?min) |