题目内容
铍原子比铝原子少1个电子层,最外层电子数也比铝原子少1,在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.下列关于铍的判断不正确的是( )
| A、Be能在空气中燃烧 |
| B、BeO熔点较低 |
| C、BeCl2是共价化合物 |
| D、Be(OH)2具有两性 |
考点:原子结构与元素的性质,元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:Be与Mg在同一主族,性质相似,Be的化合价为+2,氧化物化学式为BeO,Be(OH)2与氢氧化铝的性质相似,BeCl2与AlCl3相似.
解答:
解:A.Be与Mg同一主族化学性质相似,Mg能燃烧,则Be能在空气中燃烧,故A正确;
B.在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,Al2O3的熔点很高,则BeO熔点较高,故B错误;
C.BeCl2与AlCl3相似,氯化铝是共价化合物,则BeCl2也是共价化合物,故C正确;
D.Be(OH)2与氢氧化铝的性质相似,氢氧化铝是两性氢氧化物,则Be(OH)2也具有两性,故D正确,
故选B.
B.在周期表中铍和铝的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,Al2O3的熔点很高,则BeO熔点较高,故B错误;
C.BeCl2与AlCl3相似,氯化铝是共价化合物,则BeCl2也是共价化合物,故C正确;
D.Be(OH)2与氢氧化铝的性质相似,氢氧化铝是两性氢氧化物,则Be(OH)2也具有两性,故D正确,
故选B.
点评:本题考查了元素周期表知识,明确对角线规则是解本题关键,根据Al及其化合物的性质利用知识迁移的方法分析解答,题目难度不大.

练习册系列答案
相关题目
 有一化学平衡:mA(g)+nB(s)?pC(g)+qZ(g)体系,生成物Z的质量和外界压强、温度的关系(如图).分析图中曲线可以得出的结论是( )
有一化学平衡:mA(g)+nB(s)?pC(g)+qZ(g)体系,生成物Z的质量和外界压强、温度的关系(如图).分析图中曲线可以得出的结论是( )| A、正反应吸热:m+n>p+q |
| B、正反应吸热:m+n<p+q |
| C、正反应吸热:m<p+q |
| D、正反应放热:m+n<p+q |
你认为下列实验数据不合理的是( )
| A、用pH试纸测得某河水的pH值为6.24 |
| B、用托盘天平称得氧化铜粉末的质量为11.5g |
| C、用10ml量筒取8.5ml的溶液 |
| D、测得某粗盐中氯化钠的质量分数为90.5% |
在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积减半,当达到新的平衡时,A的浓度增大为原来的1.8倍,则下列说法错误的是( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率增大了 |
| C、恒温恒压时再充入A物质,达到新的平衡时A的质量分数增加了 |
| D、a>b |
有关少量食用油在低温下出现冻结现象后能否食用及解释合理的是( )
| A、不能,因为已经变质 |
| B、不能,因为含有杂质 |
| C、不能,因为含有水份 |
| D、能,因为那只是油脂主要成份在低温下结晶析出,是正常物理形态变化,并未变质 |
每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要.钢铁防腐方法有许多种,图-1与图-2是两个典型的例子.对其中原理的描述正确的是( )
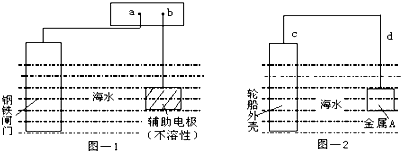

| A、图-1:a为电源正极 |
| B、图-1:辅助电极上发生氧化反应 |
| C、图-2:电流方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
下列电离方程式错误的是( )
| A、CaCl2=Ca2++2Cl- |
| B、K2SO4=2 K++SO42- |
| C、HNO3=H++NO3- |
| D、NaClO=Na++Cl-+O2- |
对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为vx,(x代表某反应物或生成物)之间的关系,正确的是( )
A、vA=
| ||
| B、vB=3vC | ||
C、vB=
| ||
D、vB=
|
下列各溶液中,Na+物质的量浓度最大的是( )
| A、1.0mol/LNaCl溶液 |
| B、1.0mol/LNa2SO4溶液 |
| C、1.0mol/LNaOH |
| D、1.0mol/LNa3PO4 |