题目内容
在一定条件下,反应N2+3H2?2NH3,在1L密闭容器中进行,5min内氨的质量增加了17g,则反应速率为
( )
( )
| A、V (H2)=0.03mol/(L?min) |
| B、V(N2)=0.2mol/(L?min) |
| C、V (NH3)=0.02mol/(L?min) |
| D、V (NH3)=0.2mol/(L?min) |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:在1L密闭容器中进行,5min内氨的质量增加了17g,n(NH3)=
=1mol,V (NH3)=
=0.2mol/(L?min),结合化学反应速率之比等于化学计量数之比计算.
| 17g |
| 17g/mol |
| ||
| 5min |
解答:
解:在1L密闭容器中进行,5min内氨的质量增加了17g,n(NH3)=
=1mol,V (NH3)=
=0.2mol/(L?min),
V(N2)=
×0.2mol/(L?min)=0.1mol/(L?min),
V (H2)=
×0.2mol/(L?min)=0.13mol/(L?min),
故选D.
| 17g |
| 17g/mol |
| ||
| 5min |
V(N2)=
| 1 |
| 2 |
V (H2)=
| 2 |
| 3 |
故选D.
点评:本题考查化学计量数与化学反应速率的关系,为高频考点,把握化学反应速率之比等于化学计量数之比为解答的关键,题目难度不大.

练习册系列答案
相关题目
每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要.钢铁防腐方法有许多种,图-1与图-2是两个典型的例子.对其中原理的描述正确的是( )
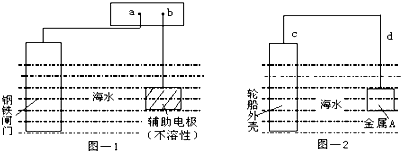

| A、图-1:a为电源正极 |
| B、图-1:辅助电极上发生氧化反应 |
| C、图-2:电流方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
Na2CO3溶液和NaHCO3溶液共同遵守的关系式是( )
| A、c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| C、c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| D、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )
| A、Mg片作负极,电极反应:Mg-2e-=Mg2+ |
| B、电子从Mg电极沿导线流向Al电极 |
| C、Al片作负极,电极反应:Al+4OH--3e-=AlO2-+2H2O |
| D、Al片上有气泡产生 |
下列各溶液中,Na+物质的量浓度最大的是( )
| A、1.0mol/LNaCl溶液 |
| B、1.0mol/LNa2SO4溶液 |
| C、1.0mol/LNaOH |
| D、1.0mol/LNa3PO4 |
 物质 A、B 的溶解度曲线如图所示(A、B 均不与水反应且不含结晶水),下列叙述中正确的是( )
物质 A、B 的溶解度曲线如图所示(A、B 均不与水反应且不含结晶水),下列叙述中正确的是( )| A、T1℃时,A、B 饱和溶液中,A 溶液的溶质的质量分数较小 |
| B、T2℃时,A、B 饱和溶液的物质的量浓度相等 |
| C、可用加热浓缩、降温结晶的方法除去 B 中混有的少量 A |
| D、T1℃时 A、B 的饱和溶液升温至 T3℃时,B 溶液的溶质的质量分数较大 |
等物质的量的下列各物质分别于盐酸反应,消耗的HCL的物质的量最少的是( )
| A、Na |
| B、CuO |
| C、Fe |
| D、Na2O |
下列反应的离子方程式书写正确的是( )
A、用惰性电极电解MgCl2溶液2Cl-+2H2O
| ||||
| B、向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O | ||||
| C、次氯酸钙溶液中通入过量的CO2:Ca2++3ClO-+H2O+CO2═CaCO3↓+2HClO | ||||
| D、氢氧化铁溶于碘化氢溶液:Fe(OH)3+3H+═Fe3++3H2O |
下列有关指定装置图的说法中正确的是( )


| A、用图1作为气体发生装置,液体由分液漏斗加入与烧瓶中固体反应,产生的难溶于水的气体用排水法测量气体体积时,排出的水的体积扣除分液漏斗加入的液体体积即为产生气体的体积 |
| B、用图2测量难溶于水的气体体积时,如果气体滞留在烧瓶中,会导致测定的氢气体积偏小 |
| C、用图3可以完成喷泉实验 |
| D、图4可以“随开随用,随关随停”地用于一些气体的制备 |