题目内容
下列物质不能通过化合反应直接得到的是( )
| A、FeCl2 |
| B、Fe(OH)3 |
| C、CuS |
| D、NaHCO3 |
考点:铁的化学性质,钠的重要化合物
专题:几种重要的金属及其化合物
分析:A.铁和氯化铁反应生成氯化亚铁;
B.氢氧化亚铁和氧气、水反应生成氢氧化铁;
C.Cu与S反应生成Cu2S;
D.碳酸钠溶液和二氧化碳反应生成碳酸氢钠.
B.氢氧化亚铁和氧气、水反应生成氢氧化铁;
C.Cu与S反应生成Cu2S;
D.碳酸钠溶液和二氧化碳反应生成碳酸氢钠.
解答:
解:A.Fe+2FeCl3=3FeCl2,所以能通过化合反应制得,故A不选;
B.Fe(OH)2与氧气、水反应生成Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故B不选;
C.Cu与S发生化合反应直接生成Cu2S,不能生成CuS,故C选;
D.Na2CO3+H2O+CO2=2NaHCO3,所以能通过化合反应制得,故D不选;
故选C.
B.Fe(OH)2与氧气、水反应生成Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故B不选;
C.Cu与S发生化合反应直接生成Cu2S,不能生成CuS,故C选;
D.Na2CO3+H2O+CO2=2NaHCO3,所以能通过化合反应制得,故D不选;
故选C.
点评:本题考查了物质间的反应,明确物质的性质是解本题关键,根据物质间的性质来分析解答,要熟练掌握元素化合物知识,灵活运用知识解答,题目难度不大.

练习册系列答案
相关题目
在一密闭容器中盛有过量的NaHCO3和少量的Na2O2,将其加热到300℃经充分反应后,排出气体,容器内残留的固体是( )
| A、NaHCO3和NaOH |
| B、Na2CO3和NaOH |
| C、NaHCO3和Na2CO3 |
| D、Na2CO3 |
在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积减半,当达到新的平衡时,A的浓度增大为原来的1.8倍,则下列说法错误的是( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率增大了 |
| C、恒温恒压时再充入A物质,达到新的平衡时A的质量分数增加了 |
| D、a>b |
每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要.钢铁防腐方法有许多种,图-1与图-2是两个典型的例子.对其中原理的描述正确的是( )
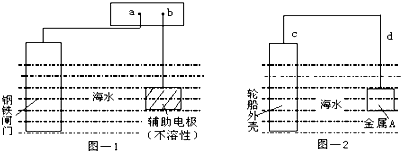

| A、图-1:a为电源正极 |
| B、图-1:辅助电极上发生氧化反应 |
| C、图-2:电流方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
下列电离方程式错误的是( )
| A、CaCl2=Ca2++2Cl- |
| B、K2SO4=2 K++SO42- |
| C、HNO3=H++NO3- |
| D、NaClO=Na++Cl-+O2- |
对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为vx,(x代表某反应物或生成物)之间的关系,正确的是( )
A、vA=
| ||
| B、vB=3vC | ||
C、vB=
| ||
D、vB=
|
Na2CO3溶液和NaHCO3溶液共同遵守的关系式是( )
| A、c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| C、c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| D、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
等物质的量的下列各物质分别于盐酸反应,消耗的HCL的物质的量最少的是( )
| A、Na |
| B、CuO |
| C、Fe |
| D、Na2O |