题目内容
室温时,用水稀释0.1mol/L氨水时,溶液中随水量的增加,
,(填写“增大”“减小”“不变”.下同),C(H+) .
| c(NH3?H2O) |
| c(OH-) |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3.H2O OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少.
OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少.
 OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少.
OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少.解答:
解:由NH3.H2O OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以分子减小的程度大,
OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以分子减小的程度大,
减小,Kw不变,所以氢离子浓度增大,故答案为:减小;增大.
 OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以分子减小的程度大,
OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以分子减小的程度大,| c(NH3?H2O) |
| c(OH-) |
点评:本题考查学生弱电解质的电离以及电离平衡的移动的影响因素知识,注意越稀越电离这一规律,难度不大.

练习册系列答案
相关题目
 下列说法中正确的是( )
下列说法中正确的是( )| A、Na2S2O3+2HCl?2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
| B、若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量NH3,由于压强增大,化学平衡向正反应方向移动 |
| C、在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图一表示 |
| D、若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图二表示 |
下列溶液中各微粒的浓度关系正确的是( )
| A、0.1mol?L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)十c(H2CO3)=c(HCO3-)+2c(CO32-) |
| C、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| D、等物质的量浓度的硫酸与醋酸钠溶液等体积混合:2c(SO42-)+c(OH-)=c(H+)+c(CH3COOH) |
下列各说法正确的是( )
| A、弱电解质的导电能力一定比强电解质的导电能力弱 |
| B、pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性 |
| C、豆浆中加入硫酸钙会使蛋白质聚沉. |
| D、同浓度①NaHCO3、②Na2CO3、③CH3COONa三种溶液,pH大小顺序是②>③>① |
某同学按图所示的装置进行电解实验.下列说法正确的是( )
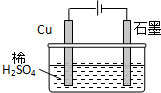

| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极上有H2析出 | ||||
| C、整个电解过程中,H+的浓度不断增大 | ||||
D、电解初期,主反应方程式为:Cu+H2SO4
|
下列说法正确的是( )
| A、铅蓄电池在放电过程中,负极质量增加,正极质量减少 | ||
B、0.1mol?L-1CH3COOH溶液加水稀释后,溶液中
| ||
| C、某吸热反应在常温下能自发进行,它一定是熵增的反应 | ||
| D、锅炉中沉积的CaSO4可直接用稀盐酸溶解除去 |
把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
| A、Al3+ |
| B、Al(OH)3 |
| C、AlO2- |
| D、Al3+和Al(OH)3 |
 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).