题目内容
14.下列说法正确的是( )| A. | 原子序数相差8的两种短周期元素,其周期序数必相差1 | |
| B. | 氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| C. | 除零族元素外,短周期元素的最高正价在数值上都等于该元素所属的族序数 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
分析 A.短周期中两元素原子序数相差8,符合条件的有:H元素与F元素或同族元素;
B.H、D、T的质子数相同;
C.O、F无正价;
D.非金属性越强,最高价含氧酸的酸性越强.
解答 解:A.短周期中两元素原子序数相差8,符合条件的有:H元素与F元素或同族元素,则周期数一定相差1,故A正确;
B.H、D、T的质子数相同,则氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为1:1:1,故B错误;
C.O、F无正价,则除O、F、零族元素外短周期元素的最高正价在数值上都等于该元素所属的族序数,故C错误;
D.非金属性越强,最高价含氧酸的酸性越强,则第三周期非金属元素最高价含氧酸的酸性从左到右依次增强,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列判断正确的是( )
| A. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| B. | 将80 g SO3溶于水并配成1 L溶液,溶质的物质的量浓度为1 mol•L-1 | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 1 mol•L-1 NaCl溶液含有NA个Na+ |
5.下列有关化学实验的操作或说法中,正确的是( )
| A. | 甘油、油脂均能使酸性KMnO4溶液褪色 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硝酸进行酸化,再加硝酸银溶液,观察现象 | |
| C. | 淀粉水解程度的检验要用到的试剂有:碘水、氢氧化钠、新制氢氧化铜 | |
| D. | 制溴苯应用液溴、铁屑和苯混合,反应中可观察到容器中有大量白色雾气 |
2.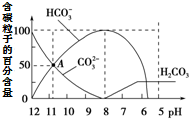 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
9.下列有关物质性质的叙述正确的是( )
| A. | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- | |
| B. | 将SO2通入含HClO的溶液中生成H2SO4,说明酸性:HClO>H2SO4 | |
| C. | 浓、稀硝酸与Cu反应的产物分别是NO2和NO,说明氧化性:稀硝酸>浓硝酸 | |
| D. | 高温时C能置换出SiO2中的Si,说明还原性:C>Si |
3.NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 标准状况下,22.4L N2和H2的混合气中含NA个原子 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
13.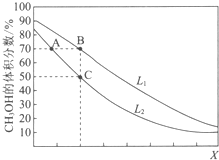 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )| A. | X代表压强 | B. | L1<L2 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |