题目内容
14.A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期.A元素原子L层上的电子数为K层的3.5倍;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的$\frac{1}{2}$和$\frac{1}{3}$;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒.请回答:
(1)写出五种微粒的符号:AF、BNa、CH、DD、EOH-.
(2)C的同位素中,C3可用符号T表示.
(3)C和D形成的分子的电子式为
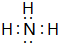 ,结构式为
,结构式为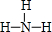 ,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.(4)用电子式表示A和B形成化合物的过程:
 .
.
分析 A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期.A元素原子L层上的电子数为K层的3.5倍,L层电子数为7,则A为F;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu,则B为Na;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的$\frac{1}{2}$和$\frac{1}{3}$,故C是H;D的气态氢化物溶于水后显碱性,则D为N;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒,则E为OH-,据此解答.
解答 解:A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期.A元素原子L层上的电子数为K层的3.5倍,L层电子数为7,则A为F;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu,则B为Na;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的$\frac{1}{2}$和$\frac{1}{3}$,故C是H;D的气态氢化物溶于水后显碱性,则D为N;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒,则E为OH-.
(1)由上述分析可知,A为F、B为Na、C为H、D为N、E为OH-,故答案为:F;Na;H;N;OH-;
(2)C的同位素中,C3可用符号T表示,故答案为:T;
(3)C和D形成的分子为NH3,电子式为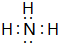 ,结构式为
,结构式为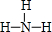 ,D的气态氢化物在催化剂存在下跟氧气反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
,D的气态氢化物在催化剂存在下跟氧气反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为: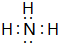 ;
;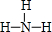 ;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)A和B形成化合物为NaF,用电子式表示形成过程: ,
,
故答案为: .
.
点评 本题考查元素化合物推断,需要学生熟练掌握元素化合物性质,难度不大.

| A. | 石油的催化重整是为了获得以汽油为主的轻质油 | |
| B. | 芳香烃主要来自于煤干馏后的煤焦油 | |
| C. | 汽油、煤油、柴油主要来自于石油的常压蒸馏 | |
| D. | 乙烯可由石油裂解得到 |
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由臭粉和明矾组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:

(2)结合步骤①~③分析,气体A为氨气(或NH3),该发酵粉的成分为NaHCO3 和NH4HCO3(填化学式).
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证.实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LNaOH溶液写出实验步骤、预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶 液分成两份,分别装入A、B试管中. | |
| 步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色 | 焰色呈黄色证明有Na+,发酵粉中有NaHCO3 |
| 步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液 | 看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾. |
| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |
| A. | 2H++2e-═H2 | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe3++e-═Fe2+ |
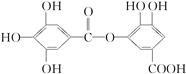 ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )| A. | 酸性条件下可发生水解反应,且产物只有一种 | |
| B. | 1mol该有机物最多可跟8molNaOH反应 | |
| C. | 1mol该有机物最多可跟2molBr2反应 | |
| D. | 该有机物可跟NaHCO3溶液反应 |
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )| A. | 原混合溶液中一定含有的离子是OH-、CO32-、AlO2-、SiO32-、Al3+ | |
| B. | AB段反应的离子方程式是H++CO32-═HCO3-,H++HCO3-═CO2↑+H2O | |
| C. | AB段之前反应的离子方程式是AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| D. | K+、Na+两种离子肯定存在其中一种 |
| A. | 氢氧化钠的电子式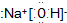 | |
| B. | 质子数为29、中子数为35的铜原子${:}_{29}^{35}$Cu | |
| C. | 氯离子的结构示意图: | |
| D. | 对苯二酚的结构简式: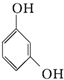 |


 .
. .
. .
.