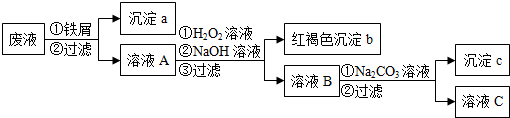
题目内容
13.常温下0.1mol/L醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
分析 醋酸电离生成醋酸根离子和氢离子,要使溶液的pH增大,则溶液中氢离子浓度减小,据此分析解答.
解答 解:A、醋酸是弱电解质,加水稀释能促进水的电离,将溶液稀释到原体积的10倍,氢离子浓度大于原来的$\frac{1}{10}$,所以pH<(a+1),故A错误;
B、加入适量的醋酸钠固体,醋酸钠中含有醋酸根离子能抑制醋酸的电离,使溶液中氢离子浓度减小,所以能使溶液pH=(a+1),故B正确;
C、加入等体积0.1 mol/L烧碱溶液,能将醋酸恰好完全反应,得到的是0.05mol/L的醋酸钠溶液,溶液显碱性,故所得溶液的pH>7,故C错误;
D、加入等体积的0.1 mol•L-1盐酸,由于HCl是强电解质,故加入0.1mol/L盐酸后氢离子浓度增大,溶液的pH值减小,故D错误;
故选B.
点评 本题考查了弱电解质的电离,根据“加水稀释、提高温度都能促进醋酸的电离,加入含有相同离子的盐能抑制醋酸的电离”来分析解答,难度不大.

练习册系列答案
相关题目
3.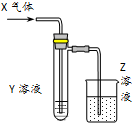 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )
 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
4.如图所示,集气瓶内充满某混合气体(括号内为体积比),若将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶中的混合气体可能是( )
①CO、O2(2:1)②NH3、O2(8:1)③NO2、O2(4:1)④N2、H2(1:3)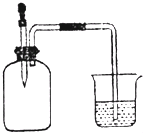
①CO、O2(2:1)②NH3、O2(8:1)③NO2、O2(4:1)④N2、H2(1:3)

| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
8.已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a.则下列说法正确的是( )
| Y | ||
| X | ||
| Z |
| A. | Y是非金属性最强的元素 | B. | Z是金属元素 | ||
| C. | Y的原子序数为a-7 | D. | X的气态氢化物化学式为H2X |
18.正确的实验操作是实验成功的基本保证.下列实验操作正确的是( )
| A. |  检查装置气密性 | B. |  蒸发 | C. |  转移液体 转移液体 | D. |  读取气体体积 读取气体体积 |
5.工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol?1,下列判断正确的是ad.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol?1,则Q<131.4
d.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol?1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
根据表中数据计算:
①0min~2min 内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad.(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为4H++O2+4e-=2H2O.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol?1,下列判断正确的是ad.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol?1,则Q<131.4
d.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol?1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min 内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad.(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为4H++O2+4e-=2H2O.
2.中国古代的下列发明创造中,不涉及化学变化的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 用黏土烧制陶瓷 | D. | 打磨磁石制指南针 |
3.X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,其相关信息如下表:
(1)X位于第二周期IVA族.W的核外电子排布式为1s22s22p63s23p63d64s2.
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.