题目内容
19.利用如图装置探究铁在海水中的电化学防护,下列说法错误的是( )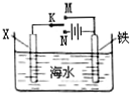
| A. | 若X为锌棒,开关K置于M处,可减缓铁的腐蚀 | |
| B. | 若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e→Fe2+ | |
| C. | 若X为碳棒,开关K置于N处,可减缓铁的腐蚀 | |
| D. | 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e→H2↑ |
分析 将开关置于N处时,铁为阴极,无论X是什么,铁均不放电,被防护,为外加电源的阴极保护法;将开关置于M处时,若X为锌,则铁作原电池的正极,为牺牲阳极的阴极保护法,以此解答该题.
解答 解:A.若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,可减缓铁的腐蚀,故A正确;
B.若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,氧气在该极发生还原反应,故B错误;
C.若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,可减缓铁的腐蚀,故C正确;
D.若X为碳棒,开关K置于N处,形成电解池,X极为阳极,发生氧化反应,铁电极为阴极,发生还原反应,故D正确.
故选B.
点评 本题考查学生原电池和电解池的工作原理以及金属的腐蚀和防护知识,为高频考点,侧重于学生的分析能力的考查,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
相关题目
9.下列关于反应H2(g)+I2(g)?2HI(g)的平衡常数K的说法中,正确的是( )
| A. | 在任何条件下,化学平衡常数是一个恒定量 | |
| B. | 改变反应物浓度或生成物浓度都会改变平衡常数K | |
| C. | 从平衡常数K的大小不能推断一个反应进行的程度 | |
| D. | 平衡常数K只与温度有关,与反应物的浓度无关 |
10.用石墨棒作阳极、铁棒作阴极电解熔融的氯化钠,下列说法中正确的是( )
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
14.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
11.对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( )
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不需要验纯 | |
| C. | 甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰较明亮 | |
| D. | 二者燃烧时都有黑烟生成 |
8.下列反应的离子方程式正确的是( )
| A. | 往Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | Na2SiO3溶液与稀醋酸混合SiO32-+2H+=H2SiO3↓ | |
| C. | 钠与CuSO4溶液反应2Na+Cu2+=Cu+2Na+ | |
| D. | 往Na2SO3溶液中滴加双氧水 H2O2+SO32-=SO42-+H2O |
9.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| C. | 0.5mol/L AlCl3溶液中Cl-的数目为1.5NA | |
| D. | 17g氨气中含有的电子数为10NA |
 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为: