题目内容
12.有0.5mol的Y元素的离子得到6.02×1023个电子后被还原成中性Y原子,另外已知0.4gY的氧化物恰好与100mL 0.2mol•L-1 的盐酸完全反应,且Y原子核内质子数和中子数相等.若Y是短周期中某种金属元素.回答下列问题:(1)Y的名称为Mg,它在周期表的位置为第三周期第ⅡA族;
(2)Y的氧化物与盐酸反应的离子方程式为MgO+2H+═Mg2++H2O.
分析 6.02×1023个电子为1mol,则0.5mol的Y元素的离子得到2mol电子还原为中性原子,则离子为Y2+,利用YO+2HCl═YCl2+H2O计算Y的摩尔质量,再利用Y原子核内质子数和中子数相等来确定Y的位置,以此来解答.
解答 解:(1)6.02×1023个电子为1mol,则0.5mol的Y元素的离子得到1mol电子还原为中性原子,则离子为Y2+,
设YO的物质的量为x,
由YO+2HCl═YCl2+H2O
1 2
x 0.1L×0.2mol/L
x=0.01mol,
则YO的摩尔质量为$\frac{0.4g}{0.01mol}$=40g/mol,
则Y的摩尔质量为40g/mol-16g/mol=24g/mol,
即Y的相对原子质量为24,又Y原子核内质子数和中子数相等,
则质子数为12,为Mg元素,位于第三周期第ⅡA族,
故答案为:Mg;第三周期第ⅡA族;
(2)化学反应为MgO+2HCl═MgCl2+H2O,MgO、H2O在离子反应中应保留化学式,则离子反应为MgO+2H+═Mg2++H2O,
故答案为:MgO+2H+═Mg2++H2O.
点评 本题考查原子结构与元素周期律,明确Y的化合价及氧化物与酸的反应是解答本题的关键,并熟悉元素的位置及元素周期律来解答,难度不大.

练习册系列答案
相关题目
20.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1L 0.1mol•L碳酸钠溶液中,阴离子数目小于0.1NA | |
| B. | 0.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
7.用FeCl3溶液无法区别的一组试剂是( )
| A. | KSCN溶液、KCl溶液 | B. | NaOH溶液、NaCl溶液 | ||
| C. | 稀盐酸、稀硝酸 | D. | AgNO3溶液、稀HNO3 |
17.下列有关化学用语表示正确的是( )
| A. | 四氯化碳分子的电子式为: | |
| B. | C1-的结构示意图: | |
| C. | 醋酸的电离方程式:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 聚丙烯的结构简式: |
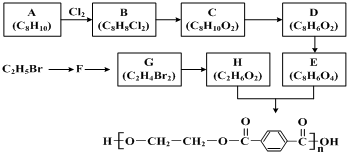
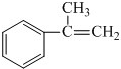
 ;
; (写出结构简式).
(写出结构简式).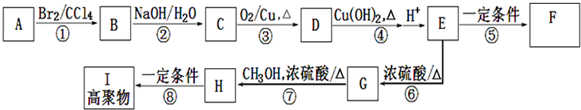
 ;E在一定条件下能形成3个六元环的物质,该物质的结构简式为:
;E在一定条件下能形成3个六元环的物质,该物质的结构简式为: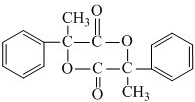 .
.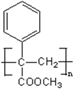 .
.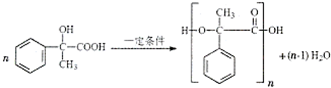 .
.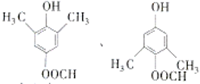 .
.
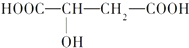
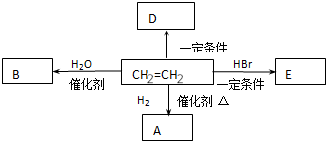
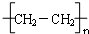 .
.