题目内容
1.苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,苹果醋是一种常见的有机酸,其结构简式为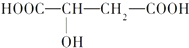
(1)苹果醋中含有的官能团的名称是羟基、羧基.
(2)苹果醋的分子式为C4H6O5.
(3)1mol苹果醋与足量Na反应,能生成标准状况下的H233.6L.
(4)苹果醋可能发生的反应是A、B、C、D.
A.与NaOH溶液反应 B.与石蕊试液作用
C.与乙酸在一定条件下发生酯化反应
D.与乙醇在一定条件下发生酯化反应
(5)两分子苹果醋发生酯化反应成C8H10O9的链状酯有2种.
分析 苹果醋分子中含有2个羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和消去反应,以此解答.
解答 解:(1)该分子中含有官能团为羟基、羧基,故答案为:羟基、羧基;
(2)该分子中含有4个C原子、6个H原子、5个O原子,其分子式为C4H6O5,故答案为:C4H6O5;
(3)分子中含有2个羧基、1个羟基,则1mol苹果醋与足量金属钠反应,可生成1.5mol氢气,在标准状况下的体积为33.6L,故答案为:33.6;
(4)分子中含有羧基,可发生中和、酯化反应,含有羟基,可发生取代、消去和氧化反应,则A、B、C、D都正确,故答案为:A、B、C、D;
(5)两分子苹果醋发生酯化反应成C8H10O9的链状酯,应脱去一分子水,对碳原子进行标号,如 和
和 ,可为1和b或4和b,有2种,故答案为:2.
,可为1和b或4和b,有2种,故答案为:2.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查醇、羧酸的性质,注意羧基或羟基与氢气之间的关系式,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.pH值相等的盐酸(甲)和醋酸(乙),分别与一定量的锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应开始时,酸的物质的量浓度:甲>乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲<乙 | |
| D. | 反应所需时间:甲<乙 |
9.4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2为工业制硫酸的重要要反应,下列说法正确的是( )
| A. | 02是还原剂 | B. | FeS2是氧化剂 | ||
| C. | 02失去电子 | D. | FeS2发生氧化反应 |
16. 请根据如表相关信息,回答问题.
请根据如表相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
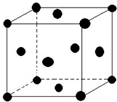
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×10{\;}^{30}M}{8ρr{\;}^{3}}$(用M、r、ρ表示).
 请根据如表相关信息,回答问题.
请根据如表相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×10{\;}^{30}M}{8ρr{\;}^{3}}$(用M、r、ρ表示).
13.W、X、Y、Z四种短周期元素的原子序数:X>W>Z>Y.W原子的最外层没有p电子,X原子核外s电子数与p电子数之比为1:1,Y原子最外层s电子数之比为1:1,Z原子的p电子数比Y原子的多2个.
(1)四种元素原子半径从大到小的顺序为Na>Mg>C>O(用元素符号表示).
(2)请用“>”或“<”填空:
(3)写出X元素的单质与Z、Y所形成的化合物反应的化学方程式,并标出电子转移的方向和数目: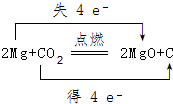 .
.
(1)四种元素原子半径从大到小的顺序为Na>Mg>C>O(用元素符号表示).
(2)请用“>”或“<”填空:
| 第一电离能 | 电负性 | 氢化物沸点 | 最高价氧化物对应水化物的碱性 |
| W<X | Z>Y | Y<Z | W>X |
 .
.
10.下列叙述中正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 当各轨道处于全满.半满.全空时原子较稳定 | |
| D. | 同一周期中,碱金属元素的第一电离能最大 |
11.汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):
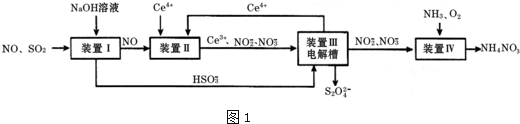
(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式2SO2+3OH-=HSO3-+SO32-+H2O
②已知混合液pH随n(SO32-):n(HSO3-)变化关系如表:
当混合液中n(SO32-):n(HSO3-)=1:1时,c(Na+)>c(HSO3-)+2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出只生成NO2-的离子方程式NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示.

①生成的Ce4+从电解槽的a(填字母序号)口流出;
②生成S2O42-的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O;
(4)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2$\frac{5600a}{23}$ L.(用含a代数式表示)

(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式2SO2+3OH-=HSO3-+SO32-+H2O
②已知混合液pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出只生成NO2-的离子方程式NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示.

①生成的Ce4+从电解槽的a(填字母序号)口流出;
②生成S2O42-的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O;
(4)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2$\frac{5600a}{23}$ L.(用含a代数式表示)
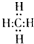 ,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.
,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.