题目内容
2.下列离子方程式中,书写正确的是( )| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O?H3O++B2- | |
| B. | 电解盐酸:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | NaHCO3的电离:NaHCO3?Na++HCO3- |
分析 A.水解生成弱酸、氢氧根离子;
B.电解盐酸生成氢气、氯气;
C.正极上氧气得到电子;
D.为强电解质,完全电离.
解答 解:A.弱酸酸式盐NaHB在水溶液中水解离子反应为HB-+H2O?H2B+OH-,故A错误;
B.电解盐酸的离子反应为2C1-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑,故B错误;
C.氢氧燃料电池在碱性介质中的正极反应式为O2+2H2O+4e-=4OH-,故C正确;
D.NaHCO3的电离方程式为NaHCO3=Na++HCO3-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意电离、水解、电解反应的判断,题目难度不大.

练习册系列答案
相关题目
12.将K、SiO2、Na2O、NaOH、NaHSO4分别加热熔化,需要克服相同类型作用力的物质有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.下列关于磷酸(H3PO4)的说法中正确的是( )
| A. | 1molH3PO4的质量为98g•mol-1 | B. | H3PO4的摩尔质量为98g | ||
| C. | 9.8g H3PO4含有NA个H3PO4分子 | D. | NA个H3PO4分子的质量为98g |
17.下列说法中,不正确的是( )
| A. | 化学是以实验为基础的自然科学 | |
| B. | 化学是一门创造性的、实用性的科学 | |
| C. | 人类的化学实践活动起始于近代 | |
| D. | 现代化学,可称之为21世纪的中心科学 |
7.反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 体积不变,增加H2O(g)的量 | |
| B. | 保持体积不变,充入Ne使体系压强增大 | |
| C. | 将容器的体积缩小一半 | |
| D. | 压强不变,充入He使容器的体积增大 |
11.下列有关物质分类或归类正确的是( )
①混合物:漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物
②化合物:CaCl2、NaOH、HCl、HT
③同素异形体:C60、碳纳米管、金刚石、石墨
④电解质:胆矾、苛性钠、冰醋酸、氧化钾
⑤煤的干馏、煤的汽化和液化都属于化学变化
⑥硅酸盐:光导纤维、水晶、玻璃、水玻璃.
①混合物:漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物
②化合物:CaCl2、NaOH、HCl、HT
③同素异形体:C60、碳纳米管、金刚石、石墨
④电解质:胆矾、苛性钠、冰醋酸、氧化钾
⑤煤的干馏、煤的汽化和液化都属于化学变化
⑥硅酸盐:光导纤维、水晶、玻璃、水玻璃.
| A. | ①②④⑤ | B. | ③④⑤ | C. | ③④⑥ | D. | ①②③④⑤⑥ |
1.下列说法正确的是( )
| A. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,则原溶液中一定有CO32- | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI2 | |
| D. | 一定量氯气通入30mL 10mol•L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
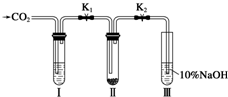 某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: