题目内容
8.下列高分子化合物的认识不正确的是( )| A. | 有机高分子化合物被称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而得到的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构很复杂 | |
| C. | 对于一块高分子材料来说,n是一个整数值,因而它的相对分子质量是确定的. | |
| D. | 材料可分为天然高分子材料和合成高分子材料两大类 |
分析 A、有机高分子化合物多是由小分子通过聚合反应而制得;
B、相对分子质量只与聚合对有关,与结构无关;
C、高分子化合物中n是不确定的,无法确定其相对分子量;
D、高分子材料按来源分为天然、合成高分子材料.
解答 解:A、高分子化合物主要是由小分子通过加聚、缩聚两类反应制得,故A正确;
B、有机高分子化合物的相对分子质量很大,但与结构无关,有的简单,有的复杂,故B错误;
C、对于一块高分子材料,n是一个整数值,由于n不确定,所以它的相对分子质量也不确定,故C错误;
D、高分子材料按来源分为天然、合成高分子材料,故D正确.
故选BC.
点评 本题考查了有机高分子化合物的结构和性质,题目难度不大,注意高分子化合物是由许多链节结构相同而聚合度不同的化合物所组成的混合物.

练习册系列答案
相关题目
4.从海带中提取碘要经过灼烧、浸取、过滤、氧化、萃取、分液、蒸馏等操作,下列对应的装置合理,操作规范的是( )
| A. |  海带灼烧成灰 | B. |  过滤含I-溶液 | C. |  放出碘的苯溶液 | D. |  分离碘并回收苯 |
5.下列说法中正确的是( )
| A. | NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 | |
| C. | 在同一能级上运动的电子,其运动状态可能相同 | |
| D. | 若ABn的中心原子A上没有未用于形成共价键的孤对电子,当n=3,则分子结构为三角锥形 |
2.H2、Cl2、O2组成混合气体,一定条件下恰好完全反应生成盐酸,则原混合气体中,H2、Cl2、O2的物质的量之比正确的是( )
| A. | 3:2:1 | B. | 6:1:2 | C. | 7:1:3 | D. | 7:4:1 |
3.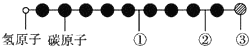 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烷烃 | ||
| C. | ②处的化学键表示碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
20.下面关于硅的叙述中,正确的是( )
| A. | 硅的化学性质稳定,常温下不与任何物质反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅元素在地壳中的含量居第一位 | |
| C. | 硅在自然界中可以以游离态存在 | |
| D. | 高纯度的单质硅被广泛用于制作计算机芯片 |
17.下列有机物的命名错误的是( )
| A. | 1,2,4-三甲苯 | B. | 2,4,4-三甲基戊烷 | ||
| C. | 2-丁醇 | D. | 2-甲基丁烯 |
18.新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti原子的外围电子排布图为 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.
②LiBH4由Li+和BH4-构成.BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3,
BH4-内部含有的微粒间作用力有cd(a.离子键b.非极性键c.极性键d.配位键e.氢键).
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,
H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3
(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti原子的外围电子排布图为
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.②LiBH4由Li+和BH4-构成.BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3,
BH4-内部含有的微粒间作用力有cd(a.离子键b.非极性键c.极性键d.配位键e.氢键).
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,
H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3
(只列算式,不必计算出数值,阿伏加德罗常数为NA)