题目内容
1.某温度时,在一体积不变的容器中充入A、B各1mol,反应进行到10s时,测得容器中含有A:0.8mol;B:0.4mol;C:0.4mol.据此回答该反应的化学方程式为( )| A. | A+3B═C | B. | 2A+B═C | C. | A+3B═2C | D. | A+3B═3C |
分析 相同时间内A、B、C的物质的量变化量之比等于化学计量数之比,据此回答.
解答 解:相同时间内A、B、C的物质的量变化量之比为(1-0.8):(1-0.4):0.4=0.2:0.6:0.4=1:3:2.相同时间内A、B、C的物质的量变化量之比等于化学计量数之比,该反应的化学方程式为A+3B═2C,
故选C.
点评 本题考查学生化学方程式的系数和物质的量的变化量之间的关系知识,属于基本知识的考查,难度中等.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
14.常温下,下列溶液中可能大量共存的离子组是( )
| A. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| C. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| D. | 含大量Fe3+的溶液中:K+、I-、NH4+、SCN- |
9.关于可逆反应达到平衡状态的说法错误的是( )
| A. | 外界条件不能改变平衡状态 | B. | 达平衡时正、逆反应速率相等 | ||
| C. | 各组分的含量不随时间而变化 | D. | 是动态平衡 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 2.24 L CH4气体中含有的电子数为NA | |
| B. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1NA个氯气分子溶于水形成1 L溶液,所得溶液中c(Cl-)=0.1 mol/L | |
| D. | 1 mol CH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目为NA |
13.①Na3N+3H2O=3NaOH+NH3↑
②NaH+H2O=NaOH+H2↑
③2Na+2H2O=2NaOH+H2↑,
④2F2+2H2O=4HF+O2
有关上述反应叙述不正确的是( )
②NaH+H2O=NaOH+H2↑
③2Na+2H2O=2NaOH+H2↑,
④2F2+2H2O=4HF+O2
有关上述反应叙述不正确的是( )
| A. | 离子半径:N3->F->Na+ | |
| B. | 上述反应除①外都是氧化还原反应 | |
| C. | 反应②③中的水做氧化剂,每生成1mol H2,转移的电子数为2NA | |
| D. | 反④中的水是还原剂 |
10.下列说法正确的是( )
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| D. | Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
11.下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$ nCl2+Cl2↑+2H2O
②4HCl(g)+O2 $\frac{\underline{\;催化剂\;}}{△}$2Cl2+2H2O(g)
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂氧化性由强到弱的顺序是( )
①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$ nCl2+Cl2↑+2H2O
②4HCl(g)+O2 $\frac{\underline{\;催化剂\;}}{△}$2Cl2+2H2O(g)
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂氧化性由强到弱的顺序是( )
| A. | O2 MnO2 KMnO4 | B. | KMnO4 MnO2O2 | ||
| C. | MnO2KMnO4 O2 | D. | O2 KMnO4 MnO2 |
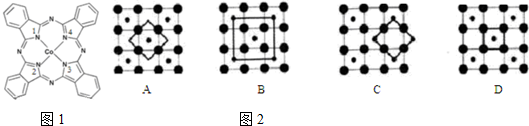
 ),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.
),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.