题目内容
19.下列能形成原电池的装置(溶液均为稀硫酸)是( )| A. |  | B. |  | C. |  | D. |  |
分析 原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此分析解答.
解答 解:A、没有有两个活泼性不同的电极,不符合原电池的构成条件,所以不能形成原电池,故A错误;
B、没有有两个活泼性不同的电极,不符合原电池的构成条件,所以不能形成原电池,故B错误;
C.液体为H2SO4溶液,两个电极材料分别为Fe、Cu,Fe能够与稀硫酸反应,所以能构成原电池,故C正确;
D、该装置不能构成闭合回路,所以不能构成原电池,故D错误;
故选C.
点评 本题考查了原电池原理,明确原电池构成条件是解本题关键,根据原电池构成条件分析解答即可,这几个条件必须同时具备,缺一不可,题目难度不大.

练习册系列答案
相关题目
9.某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为AgCl(g)  Ag+(aq)+Cl-(aq).
Ag+(aq)+Cl-(aq).
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3-,还含有的离子有Ag+、Cl-.
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为2AgCl(s)+S2-═Ag2S(s)+2Cl-.沉淀转化的主要原因是该温度下,Ag2S比AgCl溶解度更小.
(4)已知:Ag++2NH3•H2O Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因AgCl(g) Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
(5)结合上述信息分析,下列预测不正确的是BC.
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解.
| 步骤和现象 | 现象 |
| Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y | |
| Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
| Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
| Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
 Ag+(aq)+Cl-(aq).
Ag+(aq)+Cl-(aq).(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3-,还含有的离子有Ag+、Cl-.
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为2AgCl(s)+S2-═Ag2S(s)+2Cl-.沉淀转化的主要原因是该温度下,Ag2S比AgCl溶解度更小.
(4)已知:Ag++2NH3•H2O Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因AgCl(g)
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.(5)结合上述信息分析,下列预测不正确的是BC.
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解.
7.下列说法正确的是( )
| A. | 1mol苯乙烯能与4mol H2发生加成反应,说明其分子内含有4个碳碳双键 | |
| B. | 用浓Na2SO4、CuSO4溶液或浓硝酸溶液使蛋清液发生盐析,进而分离、提纯蛋白质 | |
| C. | 淀粉水解与纤维素水解时所生成的最终产物不相同 | |
| D. | 油脂可以与NaOH溶液发生皂化反应 |
14.下列物质中既含有共价键又含有离子键的是( )
| A. | KOH | B. | MgO | C. | H2SO4 | D. | CO2 |
4. 右图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )
右图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )
 右图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )
右图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )| A. | t1时,v正>v逆 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应停止 | D. | t2-t3,各物质的浓度不再发生变化 |
11.${\;}_{27}^{69}$Co是放射性元素,它的核内中子数为( )
| A. | 60 | B. | 27 | C. | 33 | D. | 42 |
8.(1)下表示元素周期表的一部分
①写出元素符号:fSi;hCl;
②c、d、e、b的原子半径由大到小的顺序是Na>Mg>Al>F;
③g、h的最高价氧化物的水化物中酸性强的是HClO4;
④a、f的氢化物中稳定性强的是SiH4.
⑤a元素和氢元素形成的化合物的电子式是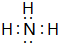 .
.
⑥c元素和b元素形成的化合物中含有的化学键类型是离子键.
(2)下表是元素周期表的一个片段,各元素均属于短周期元素

①若X的单质为空气的主要成分之一,则W的原子结构示意图 ;
;
②若Y能与钠形成反应生成淡黄色固体,则该淡黄色固体的化学式为Na2O2;含有的化学键类型有离子键、共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i |
②c、d、e、b的原子半径由大到小的顺序是Na>Mg>Al>F;
③g、h的最高价氧化物的水化物中酸性强的是HClO4;
④a、f的氢化物中稳定性强的是SiH4.
⑤a元素和氢元素形成的化合物的电子式是
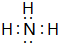 .
.⑥c元素和b元素形成的化合物中含有的化学键类型是离子键.
(2)下表是元素周期表的一个片段,各元素均属于短周期元素

①若X的单质为空气的主要成分之一,则W的原子结构示意图
 ;
;②若Y能与钠形成反应生成淡黄色固体,则该淡黄色固体的化学式为Na2O2;含有的化学键类型有离子键、共价键.
9.正丁烷的一氯代物有几种( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |