题目内容
6.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是( )| A. | NaNO3 | B. | FeCl2 | C. | NaHSO3 | D. | AgNO3 |
分析 自来水可以用氯气消毒,得到氯水中含H+、OH-、ClO-、Cl-,及水、HClO、氯气三种分子,结合微粒的性质来解答.
解答 解:自来水可以用氯气消毒,得到氯水中含H+、OH-、ClO-、Cl-,及水、HClO、氯气三种分子,反应能够与其发生反应的都会产生变质,
A.氯气不能氧化NaNO3,所以不变质,故A不选;
B.氯气能够氧化氯化亚铁,可变质,故B不选;
C.氯气能够氧化亚硫酸钠,可变质,故C不选;
D.硝酸银中的银离子能够与氯离子反应,可变质,故D不选;
故选:A.
点评 本题考查了查氯气的性质,侧重于氯水的成分与性质的考查,明确氯水的成分及所含微粒的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
17.下列实验操作正确的是( )
| A. | 向盛水的烧杯中投入小拇指头大小的钠块,观察现象 | |
| B. | 将一小块钠放在石棉网上加热,观察现象 | |
| C. | 实验后剩余的钠不能放回原瓶 | |
| D. | 用手掰开一块金属钠,观察钠的颜色 |
14.在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述中正确的是( )
| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
1.下列各组离子,能在溶液中大量共存的是( )
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
15.元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )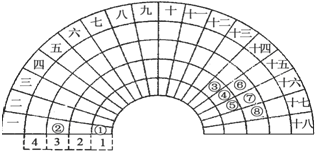

| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 | |
| C. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| D. | ②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7 |
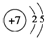 ;
;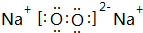 ;
;
 A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空
A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空