题目内容
0.8molCO2和0.8molCO中含有电子的物质的量之比为 ,24.5gH2SO4含 g氢原子.
考点:物质的量的相关计算
专题:计算题
分析:根据n=
结构物质的构成解答该题.
| m |
| M |
解答:
解:0.8molCO2中含有电子的物质的量为0.8mol×(6+2×8)=17.6mol,0.8molCO中含有电子的物质的量为0.8mol×(6+8)=11.2mol,
则0.8molCO2和0.8molCO中含有电子的物质的量之比为17.6mol:11.2mol=11:7;
n(H2SO4)=
=0.25mol,
n(H)=2n(H2SO4)=0.5mol,
m9H)=0.5mol×1g/mol=0.5g,
故答案为:11:7;0.5.
则0.8molCO2和0.8molCO中含有电子的物质的量之比为17.6mol:11.2mol=11:7;
n(H2SO4)=
| 24.5g |
| 98g/mol |
n(H)=2n(H2SO4)=0.5mol,
m9H)=0.5mol×1g/mol=0.5g,
故答案为:11:7;0.5.
点评:本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式以及物质的构成特点,难度不大.

练习册系列答案
相关题目
短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14.X与Z同主族,Y与W同主族,且X的原子半径小于Y.下列叙述正确的是( )
| A、原子半径:Y<Z<W |
| B、元素Z、W的简单离子的电子层结构相同 |
| C、气态氢化物的热稳定性:Y>W |
| D、X、Y、Z、W四种元素可组成共价化合物 |
下列褪色过程不是因为发生氧化还原反应而褪色的是( )
| A、将氯水滴入到干燥的红布条上,红色布条褪色 |
| B、将SO2气体通入品红溶液中,品红溶液褪色 |
| C、将SO2气体通入酸性高锰酸钾溶液中,溶液褪色 |
| D、向含有I2的淀粉溶液中加入KOH溶液,蓝色褪去 |
在同温同压下,下列各组热化学方程式中,△H1<△H2的是( )
| A、2H2 (g)+O2(g)=2H2O(g)△H1 2H2(g)+O2 (g)=2H2O(l)△H2 | ||||
| B、S(s)+O2(g)=SO2 (g)△H1 S(g)+O2(g)=SO2 (g)△H2 | ||||
C、CO(g)+
| ||||
D、H2 (g)+Cl2 (g)=2HCl(g)△H1
|
溶液、浊液、胶体的本质区别是( )
| A、透明程度 | B、分散质颗粒大小 |
| C、稳定性 | D、丁达尔现象 |

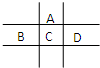 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: