题目内容
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
(5)已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)H2(g)+
| 1 |
| 2 |
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=
考点:化学平衡的影响因素,吸热反应和放热反应,用盖斯定律进行有关反应热的计算
专题:
分析:(1)由反应过程中的能量变化图可知,反应物的总能量高于生成物的总能量,故反应为放热反应;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,据此解答;
(3)只能够加快反应速率,不影响平衡移动;
(4)催化剂通过降低反应的活化能加快反应速率;
(5)据已知反应利用盖斯定律解答.
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,据此解答;
(3)只能够加快反应速率,不影响平衡移动;
(4)催化剂通过降低反应的活化能加快反应速率;
(5)据已知反应利用盖斯定律解答.
解答:
解:(1)由反应过程中的能量变化图可知,反应物的总能量高于生成物的总能量,故反应为放热反应,
故答案为:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,
故答案为:减小;该反应正反应是放热反应,升高温度平衡向逆反应移动;
(3)催化剂能加快反应速率但不改变平衡的移动,所以反应热不变,故答案为:不影响;催化剂不改变平衡的移动;
(4)加入催化剂能降低反应物质的活化能,则E1和E2都减小,故答案为:减小;减小;
(5)已知
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
据盖斯定律,②×2+③×2-①得:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3KJ/mol,故答案为:-488.3KJ/mol.
故答案为:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,
故答案为:减小;该反应正反应是放热反应,升高温度平衡向逆反应移动;
(3)催化剂能加快反应速率但不改变平衡的移动,所以反应热不变,故答案为:不影响;催化剂不改变平衡的移动;
(4)加入催化剂能降低反应物质的活化能,则E1和E2都减小,故答案为:减小;减小;
(5)已知
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③H2(g)+
| 1 |
| 2 |
据盖斯定律,②×2+③×2-①得:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3KJ/mol,故答案为:-488.3KJ/mol.
点评:本题考查了据图象判断焓变、平衡移动、催化剂对反应影响、盖斯定律的应用,题目难度中等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
下列实验操作或数据合理的是( )
| A、用过滤的方法分离Fe(OH)3胶体和HCl溶液 |
| B、用托盘天平称取25.12gNaCl固体 |
| C、分别含有Mg2+、Cu2+和Na+的三种盐溶液,用NaOH溶液就能一次鉴别开 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |
体积相同、pH相同的盐酸和醋酸溶液,与NaOH溶液中和时两者消耗NaOH的物质的量( )
| A、盐酸多 | B、醋酸多 |
| C、二者相同 | D、无法比较 |
高分子化合物的结构如下: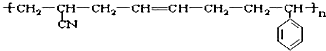 其单体可能是( )
其单体可能是( )
①CH2=CHCN;②乙烯;③1,3-丁二烯;④苯乙炔;⑤苯乙烯;⑥1-丁烯.
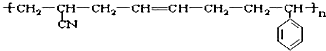 其单体可能是( )
其单体可能是( )①CH2=CHCN;②乙烯;③1,3-丁二烯;④苯乙炔;⑤苯乙烯;⑥1-丁烯.
| A、①③⑤ | B、②③⑤ |
| C、①②⑥ | D、①③④ |
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是( )
| A、NaNO2在反应中被氧化 |
| B、NaI是还原产物 |
| C、若反应过程中转移2mole-,则生成标准状况下NO的体积为44.8L |
| D、氧化剂与还原剂之比为1:2 |

 ,其分子式为
,其分子式为 外,不再含其他环状结构,还含有3个-CH3、1个-CH2-、1个
外,不再含其他环状结构,还含有3个-CH3、1个-CH2-、1个 ,它可能的结构有( )
,它可能的结构有( )