题目内容
硫铁矿烧渣(主要成分Fe 2O3、Fe 3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如图所示:

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为 .
(2)酸浸时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为 .
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是 .
(4)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为 .
(5)检验产品Ⅱ(K2SO4)中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液 .

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为
(2)酸浸时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是
(4)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为
(5)检验产品Ⅱ(K2SO4)中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤时用到的仪器有铁架台、漏斗、烧杯、玻璃棒等,所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵,实验室进行煅烧操作所需仪器有酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳;碳酸亚铁与氧气反应生成了氧化铁和二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,以此解答该题.
解答:
解:(1)若焙烧时还原剂碳燃烧产生的气体为CO,与氧化铁反应生成铁和二氧化碳气体,方程式为Fe2O3+3CO
2Fe+3CO2,
故答案为:Fe2O3+3CO
2Fe+3CO2;
(2)具有还原性,可被空气中氧气氧化,方程式为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)碳酸氢铵不稳定,加热易分解,应在温度较低的情况下加热,故答案为:防止碳酸氢铵分解;
(4)碳酸亚铁与氧气反应生成了氧化铁和二氧化碳,4FeCO3+O2
2Fe2O3+4CO2,故答案为:4FeCO3+O2
2Fe2O3+4CO2;
(5)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液.
| ||
故答案为:Fe2O3+3CO
| ||
(2)具有还原性,可被空气中氧气氧化,方程式为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)碳酸氢铵不稳定,加热易分解,应在温度较低的情况下加热,故答案为:防止碳酸氢铵分解;
(4)碳酸亚铁与氧气反应生成了氧化铁和二氧化碳,4FeCO3+O2
| ||
| ||
(5)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液.
点评:本题综合考查物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的目的和原理,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
某研究性小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定只有是Fe,因为加热温度不同,受热不均时会含有少量的Fe3O4为探究X的成分及含量,他们进行了如图所示实验.下列有关叙述中正确的是( )
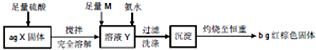

| A、取少量溶液Y,加入KSCN溶液,如果溶液不变红,则X中不含Fe3O4 | ||
| B、向钾氨水后得溶液中滴加FeCl2,如果生成红褐色沉淀,说明氨水已过量 | ||
| C、m可以是H2O2或NaClO,在实验过程中,理论上消耗两者物质的量之比为1;2 | ||
D、当b<
|
有一部分潮解和变质的氢氧化钠样品W g(即含水和碳酸钠)),将其加入到100mL2mol?L-1的稀H2SO4中充分反应后,再加入20g 20%的NaOH溶液,恰好得到中性溶液,则蒸干此中性溶液可得固体的质量为( )
| A、14.2g |
| B、19.6g |
| C、28.4g |
| D、30.4g |
已知一定温度下,2X(g)+Y(g)?mZ(g)△H=-akJ/mol(a>0);现有甲、乙两容积相等且固定的密闭容器,在保持温度不变的情况下,向密闭容器甲中通入2molX和1molY,达到平衡状态时放出的热量为bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时放出的热量为ckJ;且b>2c,则a、b、m的值或关系正确的是( )
| A、m=4 | B、a=b |
| C、a<b | D、m≤2 |
石油中几乎不含的烃是( )
| A、烷烃 | B、芳香烃 |
| C、环烷烃 | D、烯烃 |
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.