题目内容
2.一定温度下,将2mol SO2 和1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
分析 A.热化学方程式中为完全转化时的能量变化,而将2mol SO2 和1mol O2充入一定容密闭容器中,不能完全转化;
B.可逆反应中生成物不能完全转化为生成物;
C.由S原子守恒可知,反应前后含S的物质的量之和为2mol;
D.SO2的物质的量和SO3物质的量关系与转化率有关.
解答 解:A.热化学方程式中为完全转化时的能量变化,而将2mol SO2 和1mol O2充入一定容密闭容器中,不能完全转化,则放出的热量一定小于197kJ,故A错误;
B.可逆反应中生成物不能完全转化为生成物,则生成SO3一定小于2 mol,故B错误;
C.由S原子守恒可知,反应前后含S的物质的量之和为2mol,则SO2和SO3物质的量之和为2 mol,故C正确;
D.SO2的物质的量和SO3物质的量关系与转化率有关,则二者的物质的量不一定相等,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握热化学方程式的意义、化学平衡的可逆性为解答的关键,侧重分析与应用能力的考查,注意原子守恒及转化率决定物质的量关系,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
13.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1mol,则反应速率为( )
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
10.AgCl(s)?Ag+(aq)+Cl-(aq),平衡时,Ksp=c(Ag+)•c(Cl-),过量氯化银分别投入:
①100mL水
②24mL 0.1mol•L-1 NaCl
③10mL 0.1mol•L-1 MgCl2
④30mL 0.1mol•L-1 AgNO3溶液中,各溶液中c(Ag+)由大到小的顺序为( )
①100mL水
②24mL 0.1mol•L-1 NaCl
③10mL 0.1mol•L-1 MgCl2
④30mL 0.1mol•L-1 AgNO3溶液中,各溶液中c(Ag+)由大到小的顺序为( )
| A. | ③①②④ | B. | ④③②① | C. | ①②③④ | D. | ④①②③ |
17.下列表示物质结构的化学用语或模型正确的是( )
| A. | 羟基的电子式: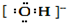 | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式:CH2 | D. | 氟离子的结构示意图: |
14.根据如表所列键能数据,下列分子中最不稳定的分子是( )
| 化学键 | H-H | H-Cl | H-Br | CI-CI | Br-Br |
| 键能( KJ•mol-1) | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
11.通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能,键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的(△H)等于反应物的总键能与生成物的总键能之差.
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) $\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热AH为( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| l键能/kJ•mol | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | +412 kJ•mol-1 | B. | -412 kJ•mol-1 | C. | +236 kJ•mol-1 | D. | -236 kJ•mol-1 |

 ;C的分子式:C2H4O;D中的官能团:羧基.
;C的分子式:C2H4O;D中的官能团:羧基. .
.