题目内容
常温下,有四种溶液:
回答下列问题:
(1)①稀释到原来的10倍后的溶液pH ④溶液的pH. (填“>”或“=”或“<”等,下同).
(2)④和⑤两溶液中水电离出的c(H+):④ ⑤.
(3)①与③混合,若溶液pH=7,则两溶液体积关系为V(NaOH) V(CH3COOH).
(4)②与④等体积混合,则溶液pH 7,其所得溶液中的溶质组成可能为: .
| ① | ② | ③ | ④ | ⑤ |
| 0.001mol?L-1 CH3COOH溶液 | pH=10 NaOH溶液 | 0.001mol?L-1 NaOH溶液 | pH=4 CH3COOH溶液 | pH=4 NH4Cl溶液 |
(1)①稀释到原来的10倍后的溶液pH
(2)④和⑤两溶液中水电离出的c(H+):④
(3)①与③混合,若溶液pH=7,则两溶液体积关系为V(NaOH)
(4)②与④等体积混合,则溶液pH
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)0.001mol/L CH3COOH溶液,稀释10倍醋酸浓度为0.0001mol/L,c(H+)<<0.0001mol/L,溶液PH>>4,pH=4的CH3COOH溶液中氢离子浓度10-4mol/L稀释10倍,促进电离,pH小于5;
(2)④pH=4的CH3COOH溶液中水电离出的氢离子浓度为10-10mol/L,⑤pH=4NH4Cl溶液两溶液中水电离出的c(H+)为10-4mol/L;
(3)①与③混合,若溶液pH=7,依据醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若成中性醋酸略过量分析;
(4)②pH=10NaOH溶液与④pH=4CH3COOH溶液等体积混合,醋酸电离平衡状态下的氢离子浓度和氢氧化钠溶液中的氢氧根离子浓度相同,等体积混合恰好反应,醋酸是弱电解质,电离平衡正向进行,又电离出氢离子,醋酸溶液浓度大于氢氧化钠溶液,说明反应后溶液为醋酸和醋酸钠.
(2)④pH=4的CH3COOH溶液中水电离出的氢离子浓度为10-10mol/L,⑤pH=4NH4Cl溶液两溶液中水电离出的c(H+)为10-4mol/L;
(3)①与③混合,若溶液pH=7,依据醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若成中性醋酸略过量分析;
(4)②pH=10NaOH溶液与④pH=4CH3COOH溶液等体积混合,醋酸电离平衡状态下的氢离子浓度和氢氧化钠溶液中的氢氧根离子浓度相同,等体积混合恰好反应,醋酸是弱电解质,电离平衡正向进行,又电离出氢离子,醋酸溶液浓度大于氢氧化钠溶液,说明反应后溶液为醋酸和醋酸钠.
解答:
解:(1)0.001mol/L CH3COOH溶液,稀释10倍醋酸浓度为0.0001mol/L,c(H+)<<0.0001mol/L,溶液PH>>4,pH=4的CH3COOH溶液中氢离子浓度10-4mol/L稀释10倍,促进电离,PH小于5,所以①稀释到原来的10倍后的溶液pH>④溶液的pH;
故答案为:>;
(2)④pH=4的CH3COOH溶液中水电离出的氢离子浓度为10-10mol/L,⑤pH=4NH4Cl溶液两溶液中水电离出的c(H+)为10-4mol/L,则两溶液中水电离出的c(H+):④<⑤;
故答案为:<;
(3)①0.001mol?L-1CH3COOH溶液与③0.001mol?L-1NaOH溶液混合,若溶液pH=7,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若成中性醋酸略过量,则两溶液体积关系为V(NaOH)<V(CH3COOH);
故答案为:<;
(4)②pH=10NaOH溶液与④pH=4CH3COOH溶液等体积混合,醋酸电离平衡状态下的氢离子浓度和氢氧化钠溶液中的氢氧根离子浓度相同,等体积混合恰好反应,醋酸是弱电解质,电离平衡正向进行,又电离出氢离子,醋酸溶液浓度大于氢氧化钠溶液,说明反应后溶液为醋酸和醋酸钠;
故答案为:<;CH3COOH和 CH3COONa.
故答案为:>;
(2)④pH=4的CH3COOH溶液中水电离出的氢离子浓度为10-10mol/L,⑤pH=4NH4Cl溶液两溶液中水电离出的c(H+)为10-4mol/L,则两溶液中水电离出的c(H+):④<⑤;
故答案为:<;
(3)①0.001mol?L-1CH3COOH溶液与③0.001mol?L-1NaOH溶液混合,若溶液pH=7,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,若成中性醋酸略过量,则两溶液体积关系为V(NaOH)<V(CH3COOH);
故答案为:<;
(4)②pH=10NaOH溶液与④pH=4CH3COOH溶液等体积混合,醋酸电离平衡状态下的氢离子浓度和氢氧化钠溶液中的氢氧根离子浓度相同,等体积混合恰好反应,醋酸是弱电解质,电离平衡正向进行,又电离出氢离子,醋酸溶液浓度大于氢氧化钠溶液,说明反应后溶液为醋酸和醋酸钠;
故答案为:<;CH3COOH和 CH3COONa.
点评:本题考查了溶液酸碱性分析判断,溶液pH计算应用,注意酸碱反应后溶液酸碱性的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
 如图a、b、c、d均为石墨电极,通电进行电解.下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解.下列说法不正确的是( )| A、甲中a电极反应式为4OH--4e-=O2↑+2H2O |
| B、电解后向乙中通入适量HCl气体,溶液组成可以恢复 |
| C、当b极有64gCu析出时,c电极产生2g气体 |
| D、电解时向乙中滴入酚酞试剂,d电极附近变红 |
以NA表示阿伏加德罗常数,下列说法错误的是( )
| A、1mol P4中P-P键的数目为6NA |
| B、1mol Na2O2晶体中含有阴阳离子总数为4NA |
| C、30g SiO2晶体中含有Si-O键数目为2NA |
| D、6g金刚石中含有的碳碳键数目为1NA |
在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
| A、物质发生化学变化并不一定都伴随着能量变化 |
| B、用实验方法和理论方法研究反应热的化学称为热化学 |
| C、只要有能量变化的都是化学变化 |
| D、任何反应中的能量变化都表现为热量变化 |
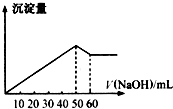 (1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
(1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为