题目内容
11.黄铜矿的主要成分是CuFeS2(硫元素-2价,铁元素+2价).实验室用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如图:
已知:CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
(1)实验室制氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)SO2和H2S有毒,会造成大气污染.
①已知SO2和H2S混合可以得到单质硫.为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为1:2.
为检验某尾气中是否含有SO2、CO2、CO三种气体,实验小组同学用如下装置设计实验.

选择上述装置(可以重复),按照气流方向其连接顺序为A→B→C→D→E→C(填序号).
(3)PbO2具有强氧化性,可与浓盐酸反应制取氯气.
①上述反应化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;由PbO与次氯酸钠溶液反应可制得PbO2,反应的离子方程式为PbO+ClO-=PbO2+Cl-.
②Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.Na2S2O3在溶液中被Cl2氧化成SO42-,则该反应的化学方程式为Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4.
③本实验存在的一个缺陷是引起重金属离子污染.
(4)按上述流程用150g黄铜矿粉末可制得48gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是73.6%(假设各步反应均完全进行且过程中无额外物质损耗).
分析 (1)实验室制氯气用二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)①根据SO2和H2S混合反应生成单质硫和水判断二者体积(标准状况)比;为检验某尾气中是否含有SO2、CO2、CO三种气体,则按照先检验SO2,后除去SO2,再检验CO2,除去CO2,最后用CuO在加热条件下检验CO;
(3)①由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O;PbO与次氯酸钠溶液反应,PbO为还原剂生成PbO2,次氯酸根为氧化剂生成氯离子,据此书写离子方程式;
②Na2S2O3在溶液中被Cl2氧化成Na2SO4,氯气被还原成氯化钠,据此书写化学方程式;
③铅为重金属元素,会引起重金属污染;
(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3,以此计算该黄铜矿中含CuFeS2的质量分数.
解答 解:(1)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)SO2和H2S混合反应生成单质硫和水,反应方程式为:SO2+2H2S=3S↓+2H2O,所以为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为1:2;为检验某尾气中是否含有SO2、CO2、CO三种气体,则按照先检验SO2,后除去SO2,再检验CO2,除去CO2,最后用CuO在加热条件下检验CO,又A中品红溶液检验SO2,B中酸性高锰酸钾除去SO2,C中澄清石灰水检验CO2,D中碱石灰除去CO2,E中CO与CuO在加热条件下生成铜和CO2,最后再通入C中澄清石灰水检验有CO2生成,所以连接顺序为A→B→C→D→E→C;
故答案为:1:2;B→C→D→E→C;
(3)①由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,反应方程式为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;PbO与次氯酸钠溶液反应,PbO为还原剂生成PbO2,次氯酸根为氧化剂生成氯离子,离子方程式为:PbO+ClO-=PbO2+Cl-,故答案为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;PbO+ClO-=PbO2+Cl-;
②Na2S2O3在溶液中被Cl2氧化成Na2SO4,氯气被还原成氯化钠,根据得失电子守恒和原子守恒,反应的化学方程式为:Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4;故答案为:Na2S2O3+4Cl2+5H2O=Na2SO4+8HCl+H2SO4;
③铅为重金属元素,会引起重金属污染,所以PbO2具有强氧化性,可与浓盐酸反应制取氯气,生成PbCl2会引起重金属离子污染,故答案为:引起重金属离子污染;
(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=$\frac{\frac{48}{160}×2×184g}{150g}$×100%=73.6%,故答案为:73.6%.
点评 本题考查了物质制备过程分析判断,物质性质的理解应用,化学方程式和离子方程式书写方法,掌握基础是关键,题目难度较大.

| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 牛奶久置空气中变质腐败 | |
| D. | 向沸水中滴入FeCl3饱和溶液,适当加热,制备胶体 |
(1)设反应 ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如表:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
结合表数据,根据反应①、②推导出推导出Q1、Q2、Q3的关系式Q3=Q1-Q2,反应③是吸热(填“放”或“吸”)热反应.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,其中两个反应为:
Ⅰ.CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+CO2(g)+2H2O(g)
Ⅱ.CH4(g)+2NO2(g) $\frac{\underline{\;催化剂\;}}{\;}$N2(g)+CO2(g)+2H2O(g)
实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应Ⅱ,测得在不同温度、不同投料比时,NO2的平衡转化率如表:
| 投料比[n(NO2)/n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
投料比,则K将增大.(填“增大”、“减小”或“不变”)
②400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数17.4%.
③收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO):V(NO2)=1:1.
④在密闭容器内先通入一定量的CH4,然后再充入一定量的NO2.在不同温度下,同时发生反应Ⅱ:并在 t秒时测定其中NO2转化率,绘得图象如图所示:
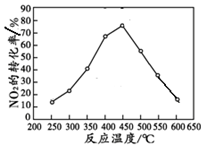
产生这一现象的原因是在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应正向进行.450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小.
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Cl-、Fe2+、K+ | D. | NO3-、AlO2-、OH-、K+ |
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)=2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 KJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
| A. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |