题目内容
18.下列叙述不正确的是( )| A | B | C | D |
 |  |  |  |
| 用酒精萃取碘水中的碘 | 烧杯中的Fe(OH)3胶体可产生丁达尔效应 | 蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 | Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酒精与水互溶;
B.丁达尔现象为胶体特有的性质;
C.蔗糖中H、O以水的形式脱出;
D.Fe(OH)2与氧气、水反应生成氢氧化铁.
解答 解:A.酒精与水互溶,不能作萃取剂,应选苯或四氯化碳,故A错误;
B.丁达尔现象为胶体特有的性质,则Fe(OH)3胶体可产生丁达尔效应,故B正确;
C.蔗糖中H、O以水的形式脱出,则浓硫酸有脱水性,故C正确;
D.Fe(OH)2与氧气、水反应生成氢氧化铁,则Fe(OH)2易被氧化,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(石墨)=C(金刚石)△H=1.9kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,则向含0.1mol/L的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | |
| D. | 2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
9.除去下列物质中混有的杂质,选择试剂及操作都正确的一项是( )
| 选项 | 物质 | 杂质 | 选择试剂 | 实验操作 |
| A | Al2O3 | SiO2 | NaOH溶液 | 过滤 |
| B | FeCl2 | FeCl3 | Fe粉 | 过滤 |
| C | CO2 | SO2 | 澄清石灰水 | 洗气 |
| D | I2 | NaCl | 酒精 | 萃取、分液 |
| A. | A | B. | B | C. | C | D. | D |
6.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂.
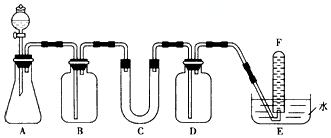
(1)A是实验室用石灰石制取CO2的装置.离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑.
(2)C中U型管内装的是Na2O2粉末,写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2NaCO3+O2.
(3)填写表中空格
(4)试管F中收集满气体后,检验该气体的方法是:取出试管,将带火星的木条伸入试管内,若木条复燃,说明该气体是O2.

(1)A是实验室用石灰石制取CO2的装置.离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑.
(2)C中U型管内装的是Na2O2粉末,写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2NaCO3+O2.
(3)填写表中空格
| 仪器 | 加入试剂 | 加入试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| D | 吸收过量CO2 | |
13.需要有适当的氧化剂才能实现的反应是( )
| A. | FeCl2→FeCl3 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | H2O2→H2O |
3.有关下列四个常用电化学装置的叙述中,正确的是( )
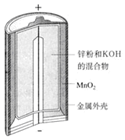 | 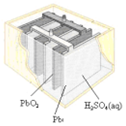 | 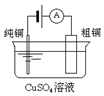 | 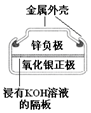 |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 | |
| B. | 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图IV所示电池工作过程中,Ag2O是氧化剂 |
10.实验室中配制250mL 0.10mol•L-1NaOH溶液时,必须使用到的玻璃仪器是( )
| A. |  锥形瓶 | B. |  试管 | C. |  分液漏斗 | D. | 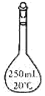 容量瓶 |
7.下列物质属于电解质的是( )
| A. | 三氧化硫 | B. | 干冰 | C. | 蔗糖溶液 | D. | 硫酸钡 |
 现有下列几种有机物:
现有下列几种有机物: .
. .
.