题目内容
3.有关下列四个常用电化学装置的叙述中,正确的是( )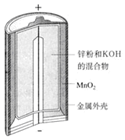 | 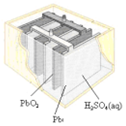 | 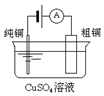 | 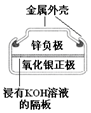 |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 | |
| B. | 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图IV所示电池工作过程中,Ag2O是氧化剂 |
分析 A.二氧化锰作正极;
B.根据放电过程中电池反应判断浓硫酸浓度变化;
C.粗铜中不仅含有铜还含有其它金属,根据转移电子守恒判断溶液中铜离子浓度是否变化;
D.在氧化还原反应中,得电子化合价降低的是氧化剂.
解答 解:A.该电池反应中二氧化锰得到电子被还原,为原电池的正极,故A错误;
B.铅蓄电池放电时电池反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中浓硫酸参加反应,所以浓度降低,故B错误;
C.粗铜中不仅含有铜还含有其它金属,电解时,粗铜中有铜和其它金属失电子,纯铜上只有铜离子得电子,所以阴极上析出的铜大于阳极上减少的铜,所以溶液中铜离子浓度降低,故C错误;
D.该原电池中,正极上氧化银得电子生成银,所以氧化剂作氧化剂发生还原反应,故D正确;
故选D.
点评 本题考查原电池和电解池原理,明确电极上发生的反应是解本题关键,难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molH2O所含质子数为8NA | |
| B. | 1摩尔氦气所含的原子数为2NA | |
| C. | 在标准状况下1L水所含分子数为$\frac{1}{22.4}$NA | |
| D. | 0.5molaL与足量盐酸反应转移的电子数为1.5NA |
18.下列叙述不正确的是( )
| A | B | C | D |
 |  |  |  |
| 用酒精萃取碘水中的碘 | 烧杯中的Fe(OH)3胶体可产生丁达尔效应 | 蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 | Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
| A. | A | B. | B | C. | C | D. | D |
15.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的 CuCl2•2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
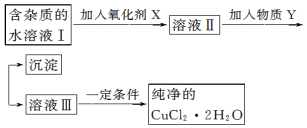
已知Cu2+、Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见表:
请回答下列问题:
(1)常温下,计算 Fe(OH)3的溶度积Ksp=10-38(mol•L-1)4(通常认为残留在溶液中的离子浓度小于1×10-5mol/L 时则沉淀完全.)
(2)加入氧化剂的目的将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
(3)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3).
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.

已知Cu2+、Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的 pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的 pH | 3.0 | 9.0 | 6.7 |
(1)常温下,计算 Fe(OH)3的溶度积Ksp=10-38(mol•L-1)4(通常认为残留在溶液中的离子浓度小于1×10-5mol/L 时则沉淀完全.)
(2)加入氧化剂的目的将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
(3)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3).
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.
12.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 18 g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1mol H2在O2中完全燃烧转移的电子数目为NA |
13.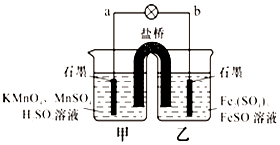 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |