题目内容
10.实验室中配制250mL 0.10mol•L-1NaOH溶液时,必须使用到的玻璃仪器是( )| A. |  锥形瓶 | B. |  试管 | C. |  分液漏斗 | D. | 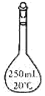 容量瓶 |
分析 配制溶液时,计算后称量、溶解、冷却、转移、定容,结合需要的仪器来解答.
解答 解:在烧杯中溶解l固体,需要玻璃棒溶解,冷却后转移到容量瓶中定容,
锥形瓶、试管可作反应容器,
分液漏斗分离分层的液体混合物,
则配制一定浓度的溶液一定需要容量瓶,
故选D.
点评 本题考查配制一定浓度的溶液,为高频考点,把握溶液配制的步骤、仪器为解答的关键,侧重分析、实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列能正确表示氧的原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
1.矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于( )
| A. | 可回收物 | B. | 可堆肥垃圾 | C. | 有害垃圾 | D. | 可燃垃圾 |
18.下列叙述不正确的是( )
| A | B | C | D |
 |  |  |  |
| 用酒精萃取碘水中的碘 | 烧杯中的Fe(OH)3胶体可产生丁达尔效应 | 蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 | Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
| A. | A | B. | B | C. | C | D. | D |
5.已知0.1mol•L-1NaHSO3溶液显酸性,且c(SO32-)<c(HSO3-),下列措施不能使溶液中c(SO32-)=c(HSO3-)>0的是.( )
| A. | 加入少量新制氯水 | B. | 加入一定量的小苏打溶液 | ||
| C. | 加入一定量的氢氧化钡固体 | D. | 加入一定量的Na2SO3固体 |
15.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的 CuCl2•2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
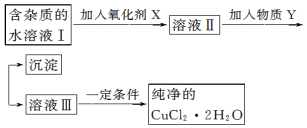
已知Cu2+、Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见表:
请回答下列问题:
(1)常温下,计算 Fe(OH)3的溶度积Ksp=10-38(mol•L-1)4(通常认为残留在溶液中的离子浓度小于1×10-5mol/L 时则沉淀完全.)
(2)加入氧化剂的目的将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
(3)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3).
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.

已知Cu2+、Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的 pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的 pH | 3.0 | 9.0 | 6.7 |
(1)常温下,计算 Fe(OH)3的溶度积Ksp=10-38(mol•L-1)4(通常认为残留在溶液中的离子浓度小于1×10-5mol/L 时则沉淀完全.)
(2)加入氧化剂的目的将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
(3)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3).
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.
2.下列叙述正确的是( )
| A. | 化学反应中需要加热的反应一定是吸热反应 | |
| B. | 化学反应中不需要加热的反应一定是放热反应 | |
| C. | 化学反应中放出的热量就是反应热 | |
| D. | 化学反应总是伴随着物质变化和能量变化 |
19.下列物成中,不属于电解质的是( )
| A. | 蔗糖 | B. | NaCl | C. | NaOH | D. | H2SO4 |