题目内容
3.下列离子方程式正确的是( )| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 漂白粉溶液在空气中发生的反应:Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| C. | 碳酸钙溶解于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氯化铁溶液与碘化钾溶液反应:Fe3++2Iˉ═Fe2++I2 |
分析 A.漏写生成氢氧化铜沉淀的离子方程式;
B.二者反应生成次氯酸和碳酸钙沉淀;
C.沉淀写化学式;
D.电荷不守恒、转移电子不守恒.
解答 解:A.漏写生成氢氧化铜沉淀的离子方程式,离子方程式为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故A错误;
B.二者反应生成次氯酸和碳酸钙沉淀,离子方程式为Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故B正确;
C.沉淀写化学式,离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.电荷不守恒、转移电子不守恒,离子方程式为2Fe3++2Iˉ═2Fe2++I2,故D错误;
故选B.
点评 本题考查离子方程式正误判断,为高频考点,把握物质性质及离子方程式书写规则是解本题关键,注意要遵循转移电子守恒、电荷守恒和原子守恒,易错选项是A.

练习册系列答案
相关题目
13.下列叙述正确的是( )
| A. | 饱和石灰水中加入少量CaO,恢复至原温度后,溶液的pH不变 | |
| B. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 | |
| C. | 盐酸中滴加氨水至中性,溶液中的溶质只有氯化铵 | |
| D. | 室温时pH=3的硫酸和pH=11的氨水等体积混合后,溶液的pH小于7 |
14.下列事实或现象与浓硫酸体现出的性质不相符的是( )
| A. | 往盛有少量胆矾的表面皿中加浓硫酸,搅拌,固体变白,体现了浓硫酸的吸水性 | |
| B. | 工业上使用铁槽车运输浓硫酸,体现了浓硫酸的强氧化性 | |
| C. | 浓硫酸与木炭在加热条件下反应,体现了浓硫酸的强氧化性和酸性 | |
| D. | 用玻璃棒蘸取浓硫酸滴在白纸上,白纸变黑,体现了浓硫酸的脱水性 |
11.与KCl的化学键类型相同的物质是( )
| A. | H2O | B. | HCl | C. | MgCl2 | D. | SO2 |
18.下列电离方程式中,不正确的是( )
| A. | NaOH═Na++OHˉ | B. | H2SO4═H2++SO42- | ||
| C. | Na2CO3═2Na++CO32- | D. | CH3COOH?CH3COOˉ+H+ |
15.下列指定条件下的离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量CO2气体:2OH-+CO2═CO32-+H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | 2 mol•L-1的NaAlO2溶液和5 mol•L-1的盐酸溶液等体积混合均匀:2AlO2-+5H+═A1(OH)3↓+Al3++H2O |
12.可逆反应 N2(g)+3H2(g)?2NH3(g),在500℃时,将2molN2 和2.25molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
| A. | 0.1mol•L-1 | B. | 0.12mol•L-1 | C. | 0.05mol•L-1 | D. | 0.16mol•L-1 |
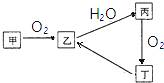 已知甲、乙、丙、丁4种物质均含有常见非金属元素,其中甲为淡黄色粉末.它们之间有如图所示的转化关系(转化过程中部分产物未标出).
已知甲、乙、丙、丁4种物质均含有常见非金属元素,其中甲为淡黄色粉末.它们之间有如图所示的转化关系(转化过程中部分产物未标出).