题目内容
向NH4HSO4溶液中加入等物质的量的NaOH溶液,则该混合溶液中离子浓度从大到小的顺序是 .
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:向NH4HSO4溶液中加入等物质的量的NaOH溶液,反应生成Na2SO4、H2O、(NH4)2SO4;然后根据各物质量的关系分析离子浓度大小.
解答:
解:向NH4HSO4溶液中加入等物质的量的NaOH溶液,反应生成Na2SO4、H2O、(NH4)2SO4;Na+、SO42-不水解,故c(Na+)=c(SO42-),NH4+水解显酸性,所以c(H+)>c(OH-),即离子浓度由大到小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-);
故答案为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-).
故答案为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-).
点评:本题考查溶液中离子浓度大小比较,注意酸碱反应的实质即可解答,侧重学生分析能力及计算能力的考查,题目难度中等.

练习册系列答案
相关题目
常温下,下列物质中能与SiO2发生反应的是( )
| A、硫酸 | B、氢氟酸 | C、水 | D、稀盐酸 |
下列有关对晶体的判断正确的是( )
| A、熔点MgO>NaCl>KCl |
| B、含有金属阳离子的晶体一定是离子晶体 |
| C、同主族元素形成的氧化物的晶体类型均相同 |
| D、沸点:H2O>PH3>NH3 |
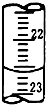 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验,请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验,请完成下列填空: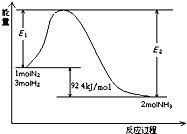
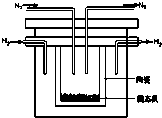
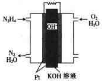 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题: