题目内容
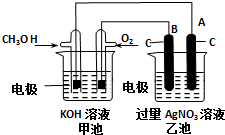 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:①通入O2的电极名称是
②通入CH3OH的电极的电极反应式是
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:燃料电池的负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,和电源的正极相连的是阳极,该极上发生氧化反应,和电源负极相连的是阴极,该极上发生还原反应;根据pH求氢离子的物质的量,再结合电极方程式计算.
解答:
解:①通入O2的电极名称是正极,B与正极相连,所以B是阳极,故答案为;正;阳;
②燃料电池的负极上是燃料发生失电子的氧化反应,即CH3OH+8OH-+6e-=CO32-+6H2O,在阴极A极上是银离子发生得电子的还原反应,即Ag++e-=Ag,
故答案为:CH3OH+8OH-+6e-=CO32-+6H2O;Ag++e-=Ag;
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则n(H+)=0.1mol,乙中阳极反应为2H2O+4e-=O2↑+4H+,所以转移的电子数目为0.1NA;
故答案为:0.1NA.
②燃料电池的负极上是燃料发生失电子的氧化反应,即CH3OH+8OH-+6e-=CO32-+6H2O,在阴极A极上是银离子发生得电子的还原反应,即Ag++e-=Ag,
故答案为:CH3OH+8OH-+6e-=CO32-+6H2O;Ag++e-=Ag;
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则n(H+)=0.1mol,乙中阳极反应为2H2O+4e-=O2↑+4H+,所以转移的电子数目为0.1NA;
故答案为:0.1NA.
点评:本题考查了原电池原理和电解池原理的应用,注意把握电极的判断及电极方程式的书写,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
相同质量的铁、锌、镁分别与足量的稀硫酸完全反应,生成氢气的质量由少到多的顺序是( )
| A、Fe<Zn<Mg |
| B、Zn<Fe<Mg |
| C、Fe<Mg<Zn |
| D、Zn<Mg<Fe |
 金属冶炼与处理常涉及氧化还原反应
金属冶炼与处理常涉及氧化还原反应

 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0