题目内容
相同质量的铁、锌、镁分别与足量的稀硫酸完全反应,生成氢气的质量由少到多的顺序是( )
| A、Fe<Zn<Mg |
| B、Zn<Fe<Mg |
| C、Fe<Mg<Zn |
| D、Zn<Mg<Fe |
考点:化学方程式的有关计算
专题:计算题
分析:铁、锌、镁与稀硫酸的反应都表现+2价,反应都可以表示为:M+H2SO4=MSO4+H2↑,由方程式可知,质量相等情况下,金属的相对原子质量越小生成氢气的质量越多.
解答:
解:铁、锌、镁与稀硫酸的反应都表现+2价,反应都可以表示为:M+H2SO4=MSO4+H2↑,
令金属的质量为m,生成氢气的质量为y,则:
M+H2SO4=MSO4+H2↑
x 2
m y
所以y=
,则质量相等情况下,金属的相对原子质量越小生成氢气的质量越多,
故生成氢气的质量:Zn<Fe<Mg,
故选B.
令金属的质量为m,生成氢气的质量为y,则:
M+H2SO4=MSO4+H2↑
x 2
m y
所以y=
| 2m |
| x |
故生成氢气的质量:Zn<Fe<Mg,
故选B.
点评:本题考查化学方程式的有关计算,难度不大,注意利用反应通式进行计算,简化计算步骤.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、Mg2+的结构示意图: |
B、C2H2的电子式: |
| C、基态Cr的价电子排布式:3d44s2 |
| D、HClO的结构式:H-Cl-O |
下列分子的中心原子杂化轨道的类型相同的是( )
| A、BeCl2和BF3 |
| B、H2O和NH3 |
| C、CO2和SO2 |
| D、HCHO和PCl3 |
下列各项化学用语中表示正确的是( )
A、Na2O2的电子式为: |
B、丙烷分子的比例模型为 |
| C、甲醛的结构简式:HCHO |
D、聚丙烯的结构简式为: |
核外电子排布中d能级最先出现在哪个能层是( )
| A、N | B、M | C、L | D、K |
下列属于人体的微量元素的是( )
| A、碘 | B、氢 | C、碳 | D、氧 |
下列图象分别表示有关反应的反应过程与能量变化的关系,其中错误的是( )


| A、石墨转变为金刚石是吸热反应 |
| B、白磷比红磷稳定 |
| C、S(g)+O2(g)=SO2 (g)△H1;S (s)+O2(g)=SO2(g)△H2,则△H1>△H2 |
| D、CO(g)+H2O(g)=CO2(g)+H2(g)△H>0 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4LCC14中含有的分子数目为NA |
| B、25℃时,1 L pH=1的醋酸溶液中含有醋酸分子数大于0.1 NA |
| C、含0.1 mol FeCl3的饱和溶液中Fe3+数目为0.1 NA |
| D、常温常压下,0.1mo1C12溶于足量NaOH溶液中,转移的电子数目为0.2NA |
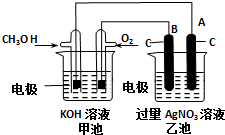 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答: