题目内容
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,反应速率v(NH3)为
(2)该反应达到平衡时H2的转化率
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol?L-1 b.0.12mol?L-1 c.0.10mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(5)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1
(6)已知:298K时,金属钠与O2气体反应,生成1mol Na2O固体时,放出热量414kJ,生成1mol Na2O2固体时,放出热量511kJ.由Na2O固体与O2气体反应生成Na2O2固体的热化学方程式为
考点:物质的量或浓度随时间的变化曲线,热化学方程式,反应速率的定量表示方法,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)由图可知,达到平衡时氨气增加0.10mol/L,依据反应速率概念计算反应速率;
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,以此计算转化率;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应;
(4)容器的体积缩小一半,压强增大,平衡向气体体积减小的方向移动;
(5)因为反应为放热反应,根据影响平衡移动的因素可知,升高温度平衡向吸热方向移动,所以该反应逆向移动,据此判断平衡常数的变化;
(6)利用盖斯定律计算出反应热,进而写出热化学方程式;
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,以此计算转化率;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应;
(4)容器的体积缩小一半,压强增大,平衡向气体体积减小的方向移动;
(5)因为反应为放热反应,根据影响平衡移动的因素可知,升高温度平衡向吸热方向移动,所以该反应逆向移动,据此判断平衡常数的变化;
(6)利用盖斯定律计算出反应热,进而写出热化学方程式;
解答:
解:(1)由图可知,达到平衡时氨气增加0.10mol/L,其反应速率为
=0.025mol/(L.min),
故答案为:0.025;
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,所以氮气的转化率为=
×100%=50%,
故答案为:50%;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应,
所以0<c(NH3)<0.2mol/L,即NH3的物质的量浓度不可能为0.2mol/L;
故答案为:a;
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半压强增大,平衡向气体体积间隙性的方向进行,平衡正向进行,故答案为:向正反应方向;
(5)因为反应为放热反应,根据影响平衡移动的因素可知,升高温度平衡向吸热方向移动,所以该反应逆向移动,平衡常数减小,即K1>K2,故答案为:>;
(6)由题意可知:①2Na(s)+
O2(g)═Na2O(s)△H1=-414kJ?mol-1,②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ?mol-1
Na2O和O2生成Na2O2的化学方程式为:2Na2O+O2=2Na2O2,可以根据(②-①)×2得到,所以反应的焓变=(-414kJ?mol-1)×2-(-511kJ?mol-1)=-194kJ?mol-1,
故答案为:2Na2O(s)+O2(s)=2Na2O2(s)△H1=-194kJ?mol-1;
| 0.1mol/L |
| 4min |
故答案为:0.025;
(2)由N2(g)+3H2(g)?2NH3(g)可知,生成氨气0.2mol时参加反应的氮气为0.1mol,所以氮气的转化率为=
| 0.1mol |
| 0.2mol |
故答案为:50%;
(3)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应,
所以0<c(NH3)<0.2mol/L,即NH3的物质的量浓度不可能为0.2mol/L;
故答案为:a;
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半压强增大,平衡向气体体积间隙性的方向进行,平衡正向进行,故答案为:向正反应方向;
(5)因为反应为放热反应,根据影响平衡移动的因素可知,升高温度平衡向吸热方向移动,所以该反应逆向移动,平衡常数减小,即K1>K2,故答案为:>;
(6)由题意可知:①2Na(s)+
| 1 |
| 2 |
Na2O和O2生成Na2O2的化学方程式为:2Na2O+O2=2Na2O2,可以根据(②-①)×2得到,所以反应的焓变=(-414kJ?mol-1)×2-(-511kJ?mol-1)=-194kJ?mol-1,
故答案为:2Na2O(s)+O2(s)=2Na2O2(s)△H1=-194kJ?mol-1;
点评:本题考查化学平衡的计算及热化学方程式的书写,明确反应速率计算、平衡的影响因素及图象的分析试剂解答本题的关键,题目难度中等

练习册系列答案
相关题目
在核磁共振氢谱中出现三组峰的化合物是( )
A、 |
B、 |
C、 |
D、 |
下列化学用语正确的是( )
A、Mg2+的结构示意图: |
B、C2H2的电子式: |
| C、基态Cr的价电子排布式:3d44s2 |
| D、HClO的结构式:H-Cl-O |
下列分子的中心原子杂化轨道的类型相同的是( )
| A、BeCl2和BF3 |
| B、H2O和NH3 |
| C、CO2和SO2 |
| D、HCHO和PCl3 |
下列图象分别表示有关反应的反应过程与能量变化的关系,其中错误的是( )


| A、石墨转变为金刚石是吸热反应 |
| B、白磷比红磷稳定 |
| C、S(g)+O2(g)=SO2 (g)△H1;S (s)+O2(g)=SO2(g)△H2,则△H1>△H2 |
| D、CO(g)+H2O(g)=CO2(g)+H2(g)△H>0 |
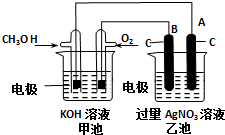 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答: