题目内容
 金属冶炼与处理常涉及氧化还原反应
金属冶炼与处理常涉及氧化还原反应(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.AlCl3 e.MgCl2
(2)辉铜矿(Cu2S)可发生反应:当1mol O2发生反应时,还原剂所失电子的物质的量为
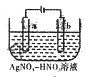
(3)如图为电解精炼银的示意图,若B极有少量红棕色气体产生,则生成该气体的电极反应式为
(4)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液,其阴极的电极反应式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的Al2O3)制得;
(2)反应中只有氧气中O元素化合价降低,据此计算转移电子数目;
(3)若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮;
(4)电解酸化的MnSO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+.
(2)反应中只有氧气中O元素化合价降低,据此计算转移电子数目;
(3)若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮;
(4)电解酸化的MnSO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+.
解答:
解:(1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物,由于AlCl3是共价化合物熔融时不导电,所以Al是电解熔融的Al2O3制得;Mg是电解熔融的MgCl2;
故答案为:bc;
(2)反应中只有氧气中O元素化合价降低,故1mol氧气反应转移电子为1mol×4=4mol;
故答案为:4;
(3)电解精炼时,粗银作阳极,纯银作阴极,所以粗银作阳极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:2H++NO3-+e-=NO2↑+H2O;
(4)阴极上得电子,发生还原反应,H+得电子生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑.
故答案为:bc;
(2)反应中只有氧气中O元素化合价降低,故1mol氧气反应转移电子为1mol×4=4mol;
故答案为:4;
(3)电解精炼时,粗银作阳极,纯银作阴极,所以粗银作阳极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:2H++NO3-+e-=NO2↑+H2O;
(4)阴极上得电子,发生还原反应,H+得电子生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑.
点评:本题考查了金属的冶炼方法、氧化还原反应、电化学原理等知识点,题目难度中等,注意把握金属冶炼的原理及电极方程式的书写方法.

练习册系列答案
相关题目
下列分子的中心原子杂化轨道的类型相同的是( )
| A、BeCl2和BF3 |
| B、H2O和NH3 |
| C、CO2和SO2 |
| D、HCHO和PCl3 |

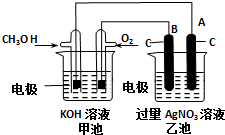 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答: