题目内容
14.化学平衡常数可以用 K 来表示,下列关于 K 的说法中正确的是( )| A. | K 越大,反应物的转化率越小 | B. | K 与温度一定有关 | ||
| C. | K 与生成物的浓度一定有关 | D. | K 与反应物的浓度一定有关 |
分析 化学平衡常数可衡量反应正向进行的程度,K越大,正向进行的程度越大,K只与温度有关,与浓度无关,以此来解答.
解答 解:A.K越大,正向进行的程度越大,则反应物的转化率越大,故A错误;
B.K为温度的函数,则K与温度有关,故B正确;
C.K与生成物的浓度无关,故C错误;
D.K与反应物的浓度无关,故D错误;
故选B.
点评 本题考查化学平衡常数,为高频考点,把握平衡常数的含义及影响因素为解答的关键,侧重分析与应用能力的考查,注意K为温度的函数,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
2.化合物A是一种新型锅炉水除氧剂,其结构式如图所示,下列说法中正确的是( )
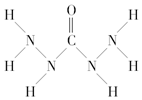

| A. | A中氧元素非金属性最强,故只有氧元素显负价 | |
| B. | 由A中的四种元素组成的化合物可能是离子化合物 | |
| C. | A分子中存在两类共价键 | |
| D. | A分子中氮原子没有孤电子对而氧原子有 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA | |
| D. | 常温常压下,1.6 g CH4含原子数为0.5NA |
3.下列关于钠的化合物的说法中,正确的是( )
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
4.在元素周期表中,在金属元素和非金属元素分界线附近能找到( )
| A. | 制半导体材料的元素 | B. | 制催化剂的元素 | ||
| C. | 制农药的元素 | D. | 制耐高温合金的元素 |
 科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H