题目内容
5.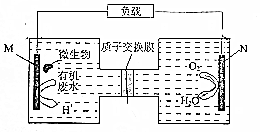 微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )| A. | M电极有CO2和N2生成 | B. | H+透过质子交换膜由左向右移动 | ||
| C. | 微生物促进了反应中电子的转移 | D. | N电极反应式为:O2+2H2O+4e-═4OH- |
分析 根据题给信息知,甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,尿素被氧化生成氮气和二氧化碳,正极上氧气得电子发生还原反应,以此解答该题.
解答 解:A.M为负极,发生氧化反应,有CO2和N2生成,故A正确;
B.原电池工作时,阳离子向正极移动,H+透过质子交换膜由左向右移动,故B正确;
C.该电池是在微生物的作用下将化学能转化为电能的装置,微生物促进了反应中电子的转移,故C正确;
D.电解质呈酸性,发生O2+4H++4e-═2H2O,故D错误.
故选D.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等.

练习册系列答案
相关题目
15.一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH?(aq)下列说法正确的是( )
| A. | 恒温下向溶液中加入CaO,Ca2+离子数目减少 | |
| B. | 恒温下向溶液中加入CaO,溶液中C(Ca2+)减小 | |
| C. | 给溶液加热,溶液的pH不变 | |
| D. | 给溶液加热,溶液的离子浓度增大 |
13.2016年世界环境日我国确定的主题是“改善环境质量,推动绿色发展”.下列做法不应该提倡的是( )
| A. | 发展清洁能源 | B. | 增加植被面积 | C. | 燃烧煤炭供热 | D. | 选择绿色出行 |
10.下列说法正确的是( )
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | H2O和H2O2互为同素异形体 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 同种元素的原子中,中子数和质子数一定都相同 |
17.下列表示不正确的是( )
| A. | HCl的电子式 | B. | SiO2的结构式O=Si=O | ||
| C. | S的原子结构示意图  | D. | 乙炔的分子式C2H2 |
14.下列有机反应:①甲烷与氯气光照反应 ②乙醛制乙酸 ③乙烯使溴水褪色 ④乙醇制乙烯 ⑤乙醛制乙醇 ⑥乙酸制乙酸乙酯 ⑦乙酸乙酯与NaOH溶液共热 ⑧液态植物油制人造脂肪 ⑨乙烯制乙醇的说法正确的是( )
| A. | ②⑤的反应类型相同 | B. | ⑥⑦的反应类型不同 | ||
| C. | ④与其他8个反应的类型都不同 | D. | ①③⑧属于同一种反应类型 |
9.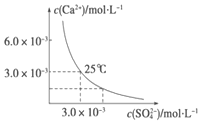 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )| A. | 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 | |
| B. | 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| C. | 溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| D. | 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
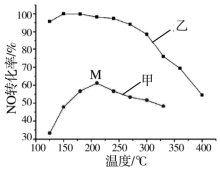 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0