题目内容
14.下列微粒互为同位素的是( )| A. | O2和O3 | B. | 1H+和 2H+ | C. | Cl和Cl- | D. | 氘和氚 |
分析 质子数相同中子数不同的原子互称同位素.互为同位素原子具有以下特征:质子数相同、化学性质相同、在周期表中的位置相同;中子数不同、质量数不同、物理性质不同;研究对象为原子.
解答 解:A.O3和O2都是由氧元素形成的结构不同的单质,互为同素异形体,故A错误;
B.1H+和 2H+相同为1,中子数不同分别为1、2,属于同种元素的不同离子,故B错误;
C.Cl和Cl-质子数相同为17,前者为原子、后者为阴离子,不能互为同位素,故C错误;
D.氘和氚符号分别为D与T,质子数相同为1,中子数不同分别为1、2,是氢元素不同核素,互为同位素,故D正确.
故选D.
点评 本题以同位素为载体,考查化学“五同”比较,题目难度不大,注意把握概念的理解.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.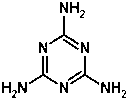 2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
 2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )| A. | 三聚氰胺属于芳香族化合物,但不属于芳香烃 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 三聚氰胺中的碳原子属于饱和碳原子 | |
| D. | 三聚氰胺分子中的所有原子都在一个平面内 |
2.下列反应的离子方程式正确的是( )
| A. | Cu与FeCl3溶液反应:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
6.在标准状况下将11.2L乙烯和乙炔的混合气体通入足量溴水中充分反应,测得有128g溴参加了反应,则乙烯和乙炔的物质的量之比为( )
| A. | 2:3 | B. | 1:2 | C. | 3:4 | D. | 4:5 |
3.将铁片放入下列足量的溶液中,使溶液质量增加的是( )
| A. | H2SO4(稀) | B. | CuSO4 | C. | FeCl3 | D. | FeCl2 |
4.北京奥运会“祥云”火炬使用的燃料为丙烷.下列关于丙烷的说法正确的是( )
| A. | 分子中的碳原子在一条直线上 | B. | 其一氯代物只有一种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 结构简式为CH3 CH2 CH3 |
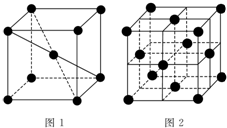 1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.
1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.