题目内容
12.下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )| A. | 稀硫酸与锌粒反应生成气体 | B. | 浓硫酸使铁、铝钝化 | ||
| C. | 浓硫酸与铜反应加热反应产生SO2 | D. | 浓硫酸和木炭在加热条件下反应 |
分析 硫酸既能表现出酸性又表现出氧化性,在反应中应生成硫酸盐,且硫酸被还原生成二氧化硫等物质,据此解答.
解答 解:A.稀硫酸与锌粒反应生成气体,只表现硫酸的酸性,故A不选;
B.浓硫酸使铁、铝钝化,只表示硫酸的强氧化性,故B不选;
C.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,硫酸既表现出了强氧化性又表现了酸性,故C选;
D.木炭粉与浓硫酸反应生成二氧化碳和二氧化硫、水,只表示硫酸的强氧化性,故D不选;
故选:C.
点评 本题考查了元素化合物知识,熟悉硫酸的强氧化性、酸性是解题关键,题目难度不大.

练习册系列答案
相关题目
2.已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-57.3kJ•mol-1,则HCN在水溶液中电离的△H等于( )
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | -69.4 kJ•mol-1 | D. | +69.4 kJ•mol-1 |
3.为了探究化学反应中的能量变化,某同学设计了如下两个实验.
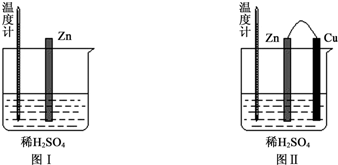
(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为2H++2e-=H2↑.

(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
7.根据金属活动性顺序表,Cu不能发生反应:Cu+2H2O═Cu(OH)2↓+H2↑.但选择恰当电极材料和电解液进行电解,这个反应就能变为现实.如表四组电极和电解液中,能实现该反应最为恰当的一组是( )
| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
| 电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
| A. | A | B. | B | C. | C | D. | D |
4.在自然界里,既有以游离态又有以化合态的形式存在的元素是( )
| A. | Cl | B. | P | C. | S | D. | Na |
1.下列说法正确的是:(NA表示阿伏加德罗常数的值)( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 6g金属镁变成镁离子时失去的电子数目为为NA | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为NA | |
| D. | 50mL 1mol/L NaCl溶液所含的Cl-物质的量0.5NA |



 :CH2=CHCH3、CH2=CH2
:CH2=CHCH3、CH2=CH2 HOCH2CH2OH、
HOCH2CH2OH、 、H2N(CH2)4COOH.
、H2N(CH2)4COOH.