题目内容
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、标况下水为液体;
C、求出氧气的物质的量,然后根据体积V=nVm来分析;
D、溶液体积不明确.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子个数小于0.5NA个,故A错误;
B、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、32g氧气的物质的量为1mol,故在标况下的体积V=nVm=1mol×22.4L/mol=22.4L,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
3.对照元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素区域可以寻找制备新型农药材料的元素 |
10.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.请回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)?Fe(s)+CO2(g) K1△H1=a KJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g) K2△H2=b KJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g) K3△H3=c KJ•mol-1
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=$\frac{6a+b+2c}{3}$KJ•mol-1(用含a、b、c的代数式表示).
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图1所示.则a>b,(填“>”、“<”或“=”),理由是由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b.
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,如图2,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是b.

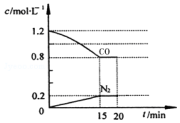
(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,将l mol CO和3mol H2加入2L的密闭容器中.实验测得n(CO)随时间的变化如表:
①下列能判断该反应达到平衡的标志是ad(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20min内v (H2)=0.04mol•L-1•min-1;在T℃时该反应的平衡常数K=1200.
③图3表示该反应中CO的转化率与温度、压强的关系.图中压强P1、P2、P3由高到低的顺序是P1>P2>P3.
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)?Fe(s)+CO2(g) K1△H1=a KJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g) K2△H2=b KJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g) K3△H3=c KJ•mol-1
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=$\frac{6a+b+2c}{3}$KJ•mol-1(用含a、b、c的代数式表示).
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图1所示.则a>b,(填“>”、“<”或“=”),理由是由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b.
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,如图2,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是b.

(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,将l mol CO和3mol H2加入2L的密闭容器中.实验测得n(CO)随时间的变化如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20min内v (H2)=0.04mol•L-1•min-1;在T℃时该反应的平衡常数K=1200.
③图3表示该反应中CO的转化率与温度、压强的关系.图中压强P1、P2、P3由高到低的顺序是P1>P2>P3.
20.下列离子方程式书写正确的是( )
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | 向NH4Al(SO4)2溶液加入含两倍物质的量的Ba(OH)2溶液:Al3++2SO${\;}_{4}^{2-}$+4OH-+2Ba2+═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 向Na2S2O3溶液中通入足量的Cl2:S2O${\;}_{3}^{2-}$+2Cl2+3H2O═2SO${\;}_{3}^{2-}$+4Cl-+6H+ | |
| D. | 用石墨电极电解MgCl2溶液阴极电极反应:2H2O+2e-═H2↑+2OH- |
4.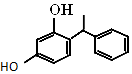 杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
 杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 分子式为C14H14O2 | |
| C. | 1 mol该物质与溴水反应时最多能消耗2 mol的Br2 | |
| D. | 该有机物能与Na2CO3溶液反应,且生成的气体能使澄清石灰水变浑浊 |
 回答下列问题:
回答下列问题: 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基.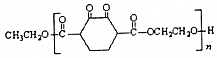 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: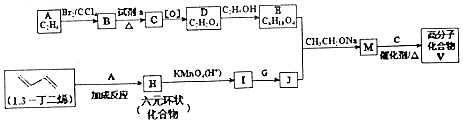
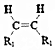 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH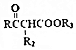 +R1OH
+R1OH CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.