题目内容
3.对照元素周期表,下列叙述中不正确的是( )| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素区域可以寻找制备新型农药材料的元素 |
分析 A.在金属与非金属元素分界线附近的元素具有一定的金属性与非金属性;
B.优良的催化剂和耐高温、耐腐蚀的合金材料大多属于过渡元素;
C.地球上元素的分布与元素在周期表中的位置无关;
D.用来制造一些农药的元素有F、Cl、S、P等.
解答 解:A.在金属与非金属元素分界线附近的元素具有一定的金属性与非金属性,可以在此寻找制备半导体材料的元素,故A正确;
B.优良的催化剂和耐高温、耐腐蚀的合金材料大多属于过渡元素,故B正确;
C.在元素周期表的右上角(非金属元素区域)可以寻找制备新型农药材料的元素,故C正确;
D.在元素周期表的右上角(非金属元素区域)可以寻找制备新型农药材料的元素,故D错误;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
13.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种原理:下列说法正确的是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1═+49.0KJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2═-192.9KJ/mol( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1═+49.0KJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2═-192.9KJ/mol( )
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. |  反应①中的能量变化如图所示,且△H1=E2-E1 | |
| C. | 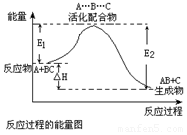 反应②中的能量变化如图所示,且△H2=E2-E1 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H>-192.9kJ•mol-1 |
14.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
18.向 10mL0.2mol/L 的氯化铝溶液中逐滴加入未知浓度的氢氧化钡溶液,测得加入15mL 和加入45mL 时,所得沉淀一样多.则原氢氧化钡溶液的浓度为( )
| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
8.下列说法不正确的是( )
| A. | 可以用丁达尔现象区分溶液和胶体 | |
| B. | 硅是良好的半导体材料,纯净二氧化硅是光导制品的基本原料 | |
| C. | SO2 使高锰酸钾褪色是利用 SO2 的漂白性 | |
| D. | 定容时俯视刻度线,会导致浓度偏高 |
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
12.战国所著《周礼》中记载沿海古人“谋饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第-步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | Ca(OH)2 | C. | SiO2 | D. | Al2O3 |
13.分子式为C5H10,且分子中含有2个甲基的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |