题目内容
5. 回答下列问题:
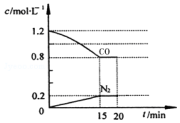
回答下列问题:(1)“霾”是当今世界环境热点话题.目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H=-a kJ•mol-1(a>0)在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
①0~15min N2的平均速率v(N2)=0.0133mol/(L•min);NO的转化率为40.0%.
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是cd(选填序号).
a.缩小容器体积
b.增加CO的量
c.降低温度
d.扩大容器体积
(2)实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因存在 Fe3++3H2O Fe(OH)3+3H+,增大H+浓度,平衡逆向移动,抑制FeCl3水解.
(3)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl.NH2Cl能与水反应生成可以杀菌消毒的物质(元素化合价不变).NH2Cl与水反应的化学方程式是NH2Cl+H2O=HClO+NH3.
分析 (1)①根据v=$\frac{△c}{△t}$计算v(N2),根据n=△c×V计算生成N2的物质的量,根据方程式计算参加反应NO物质的量,进而计算NO的转化率;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
b.增加CO的量,CO的浓度增大;
c.降低温度,平衡向正反应方向移动;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
(2)Fe3+在溶液中水解显酸性,通过增大H+浓度的方式抑制Fe3+水解;
(3)根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3.
解答 解:(1)①由图可知,15min N2的浓度变化量为0.2mol/L,则v(N2)=$\frac{0.2mol/L}{15min}$=0.0133mol/(L•min),生成氮气为2L×0.2mol/L=0.4mol,则参加反应的NO为2×0.4mol=0.8mol,故NO的转化率为$\frac{0.8mol}{2mol}$×100%=40.0%,
故答案为:0.0133mol/(L•min);40.0%;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a错误;
b.增加CO的量,平衡虽然向正反应方向移动,但CO的转化率减小,到平衡时CO的浓度增大,故b错误;
c.降低温度,平衡向正反应方向移动,到达新平衡时CO的浓度减小,故c正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但CO的物质的量增大程度小于体积增大程度,所以CO浓度减小,
故答案为:cd;
(2)因为Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+,水解后溶液显酸性,所以通过增大H+浓度的方式抑制Fe3+水解,
故答案为:存在 Fe3++3H2O Fe(OH)3+3H+,增大H+浓度,平衡逆向移动,抑制FeCl3水解;
(3)根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3,方程式为NH2Cl+H2O=HClO+NH3,
故答案为:NH2Cl+H2O=HClO+NH3.
点评 本题考查化学平衡计算与影响因素、化学反应速率的计算、等效平衡、盐类水解、氧化还原反应等,为高频考点,是对学生综合能力的考查,需要学生具备扎实的基础与灵活应用能力,难度中等.

| A. | 室温,0.1mol•L-1的CH3COOH溶液中:c(CH3COOH)<c(CH3COO-) | |
| B. | 1L 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 室温,0.1mol•L-1的CH3COONa、NaOH和Na2CO3三种溶液,pH大小的顺序为:NaOH<CH3COONa<Na2CO3 | |
| D. | 向0.01mol•L-1的NaHSO4溶液中滴加NaOH溶液至中性时:c(SO${\;}_{4}^{2-}$)>c(Na+)>c(OH-)=c(H+) |
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1═+49.0KJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2═-192.9KJ/mol( )
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | 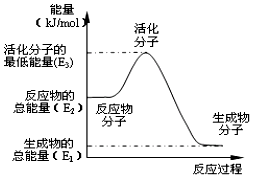 反应①中的能量变化如图所示,且△H1=E2-E1 | |
| C. | 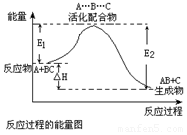 反应②中的能量变化如图所示,且△H2=E2-E1 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H>-192.9kJ•mol-1 |
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | NH4+-气体法 | B. | I--沉淀法 | ||
| C. | Na+-显色法 | D. | CO32--气体法和沉淀法 |
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为: