题目内容
3.过氧化钙较稳定,不溶于乙醇,微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.
回答下列问题:
(1)大理石经过溶解、沉淀、过滤、在沉淀、再过滤,得到CaCO3,其目的是除去杂质,得到纯净的碳酸钙(或提纯碳酸钙);过滤需要用到的玻璃仪器主要有漏斗、烧杯和玻璃棒.
(2)反应①的具体操作作为逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是除去溶液中溶解的CO2.
(3)反应②的化学方程式为CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl或CaCl2+2NH3•H2O+H2O2=CaO2+2NH4Cl+2H2O,该反应需要在冰浴下进行,原因是温度过高时过氧化氢分解.
(4)白色晶体水洗时,判断是否洗净的方法是取少量末次水洗液于试管中,滴加稀硝酸酸化后再滴加AgNO3 溶液;使用乙醉洗涤的目的是去除晶体表面的水分.
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品.该法的优点是工艺简单、操作简单.所得产品的缺点是纯度较低.
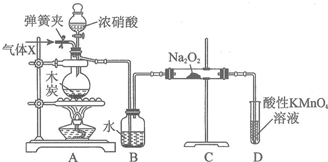
(6)CaO2•8H2O加热脱水的过程中,需不断通入氧气.目的是抑制过氧化钙分解.若通入的氧气中混有二氧化碳,其后果是二氧化碳与过氧化钙反应生成碳酸钙;已知CaO2在350℃迅速分解生成CaO和O2.图是实验室测定产品中CaO2含量的装置(夹持装置省略).

若所取产品质量为ag,测得生成气体的体积为VmL(已换算成标准状况),则产品中CaO2的质量分数为$\frac{9V}{1400a}$×100%(用含a、V的式子表示).
分析 大理石含杂质铁的氧化物,加入稀盐酸溶解得到氯化钙、氯化铁溶液,加入氨水沉淀铁离子,过滤得到滤渣主要为氢氧化铁,滤液中加入碳酸铵沉淀钙离子过滤得到沉淀碳酸钙,反应①是逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是除去溶液中溶解的CO2,反应②滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过滤得到过氧化钙晶体,水洗、乙醇洗、烘烤得到过氧化钙固体,
(1)大理石中含铁的氧化物,沉淀溶解沉淀、过滤、再沉淀、再过滤目的是除去杂质离子;过滤装置有烧杯、玻璃棒、漏斗;
(2)将溶液煮沸的作用是除去溶液中二氧化碳;
(3)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体;过氧化氢热易分解;
(4)白色晶体水洗时,表面可能粘有氯离子,结合氯离子的检验方法设计实验检验;过氧化钙较稳定,不溶于乙醇;
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品混有杂质;
(6)二氧化碳和过氧化钙发生反应生成碳酸钙,过氧化钙分解生成氧化钙和氧气,结合生成的氧气物质的量计算过氧化钙物质的量得到质量来计算过氧化钙的质量分数.
解答 解:大理石含杂质铁的氧化物,加入稀盐酸溶解得到氯化钙、氯化铁溶液,加入氨水沉淀铁离子,过滤得到滤渣主要为氢氧化铁,滤液中加入碳酸铵沉淀钙离子过滤得到沉淀碳酸钙,反应①是逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是除去溶液中溶解的CO2,反应②滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过滤得到过氧化钙晶体,水洗、乙醇洗、烘烤得到过氧化钙固体,
(1)大理石中含铁的氧化物,大理石经过溶解、沉淀、过滤、再沉淀、再过滤,得到CaCO3,其目的是,除去杂质,得到纯净的碳酸钙(或提纯碳酸钙),过滤装置有烧杯、玻璃棒、漏斗,过滤需要用到的玻璃仪器主要有漏斗、烧杯和玻璃棒,
故答案为:除去杂质,得到纯净的碳酸钙(或提纯碳酸钙;玻璃棒;
(2)反应①的具体操作作为逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是,除去溶液中溶解的二氧化碳,
故答案为:除去溶液中溶解的CO2;
(3)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,反应的化学方程式为:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl或CaCl2+2NH3•H2O+H2O2=CaO2+2NH4Cl+2H2O,该反应需要在冰浴下进行,原因是过氧化氢热易分解,
故答案为:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl或CaCl2+2NH3•H2O+H2O2=CaO2+2NH4Cl+2H2O;温度过高时过氧化氢分解;
(4)白色晶体水洗时,表面可能粘有氯离子,结合氯离子的检验方法设计实验检验,白色晶体水洗时,判断是否洗净的方法是:取少量末次水洗液于试管中,滴加稀硝酸酸化后再滴加AgNO3 溶液,使用乙醉洗涤的目的是过氧化钙较稳定,不溶于乙醇,
故答案为:取少量末次水洗液于试管中,滴加稀硝酸酸化后再滴加AgNO3 溶液;去除晶体表面的水分;
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品混有杂质,该法的优点是工艺简单、操作简单.所得产品的缺点是得到产品纯度低,
故答案为:纯度较低;
(6)CaO2•8H2O加热脱水的过程中,需不断通入氧气.目的是抑制过氧化钙分解.若通入的氧气中混有二氧化碳,其后果是二氧化碳和过氧化钙发生反应生成碳酸钙,过氧化钙分解生成氧化钙和氧气,2CaO2=2CaO+O2↑,若所取产品质量为ag,测得生成气体的体积为VmL(已换算成标准状况),氧气物质的量=$\frac{V×1{0}^{-3}L}{22.4L/mol}$,则得到过氧化钙物质的量=$\frac{V×1{0}^{-3}}{22.4}×2$mol=$\frac{V×1{0}^{-3}}{11.2}$mol,
结合生成的氧气物质的量计算过氧化钙物质的量得到质量来计算过氧化钙的质量分数=$\frac{\frac{V×1{0}^{-3}}{11.2}×72g/mol}{ag}$×100%=.$\frac{9V}{1400a}$×100%,
故答案为:$\frac{9V}{1400a}$×100%.
点评 本题考查了制备和提纯的分析应用,实验基本操作、含量计算等知识点,掌握基础是解题关键,题目难度中等.

(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
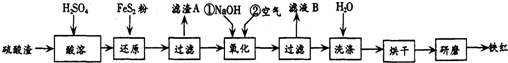
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O=15Fe2++2SO42-+16 H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2-3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| A. | 反应前后气体的压强之比为2:1 | |
| B. | 反应前后气体的密度之比为15:16 | |
| C. | 此时CO的转化率为50% | |
| D. | 如果反应继续向正向进行,气体的平均相对分子质量将减小 |
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |
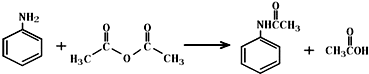
 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.已知:
| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
①取5.0mL 苯胺(密度1.04g/mL),倒入100mL锥形瓶中,加入20mL水,在旋摇下分批加入6.0mL乙酸酐(密度1.08g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
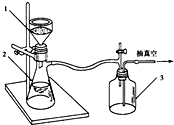
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤(用于分离粒径较细的沉淀与溶剂,利用抽气泵使抽滤瓶中的压强降低,加快过滤速度),洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)苯胺与乙酸反应的方程式为
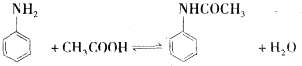 .
.(2)步骤②洗涤粗产品时,选用的溶剂是B.
A.热水 B.冷水
C.1:3的乙醇溶液 D.滤液
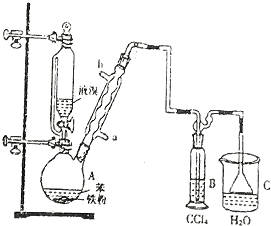
(3)步骤③两次用到过滤,其中过滤Ⅰ选择趁热过滤,是为了除去吸附有色物质的活性炭,为加快过滤速度,可采用右图所示的抽滤装置,这样做的优点是快速达到固液分离的目的,防止过滤太慢温度降低导致其他产物析出,影响产率.
(4)配制热溶液时,加入过量溶剂的作用是AB.
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(5)步骤③中以下哪些操作不能提高产率C.
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附;
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体.
A.①④⑤B.①④C.④⑤D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,该实验的产率为89%(保留两位有效数字).
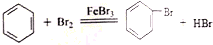 .
.