题目内容
20.第4周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )| A. | 原子半径比钾的原子半径大 | B. | 氯化物难溶于水 | ||
| C. | 其氢氧化物的碱性比NaOH强 | D. | 碳酸盐难溶于水 |
分析 第4周期某主族元素的原子,它的最外电子层上有2个电子,则为第IIA族元素,所以是Ca元素,结合元素周期率的递变性和相似性解答该题.
解答 解:第4周期某主族元素的原子,它的最外电子层上有2个电子,则为第IIA族元素,所以是Ca元素,
A.同周期原子半径从左到右逐渐减小,所以原子半径比钾的原子半径小,故A错误;
B.氯化钙易溶于水,故B错误;
C.氢氧化钠为强碱,而氢氧化钙为中强碱,氢氧化钠碱性较强,且钠的金属性较强,对应的氢氧化氢的碱性也较强,故C错误;
D.碳酸钙难溶于水,故D正确;
故选D.
点评 本题考查了周期表的结构及元素推断,为高频考点,侧重于学生的分析能力的考查,注意把握周期表中元素性质的递变规律,题目难度一般.

练习册系列答案
相关题目
11.下列化学用语中,说法正确的是( )
| A. | CO2分子的结构式O-C-O | B. | 乙醇的分子式C2H6O | ||
| C. | Mg2+结构示意图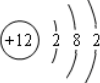 | D. | NaCl的电子式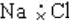 |
15.已知X、Y、Z、W均为元素周期表中的短周期元素,具有如下特征:
(1)W的元素符号是S,其原子结构示意图为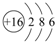 .
.
(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是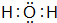 .
.
(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
 .
.(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是
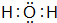 .
.(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
 +O2+xOH-
+O2+xOH- Fe3O4↓+S4O
Fe3O4↓+S4O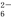 +2H2O。
+2H2O。 =____________.
=____________. 液态HCl不能导电
液态HCl不能导电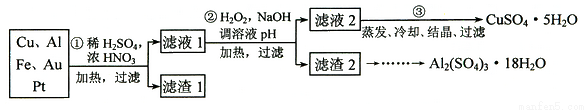
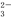 ===2I-+S4O
===2I-+S4O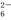 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。