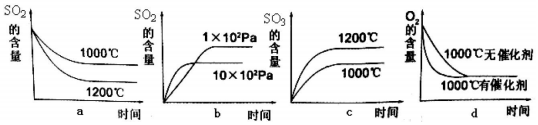
题目内容
17.下列实验装置选择正确,能达到目的是( )| A. | 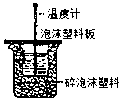 测定酸碱反应中和热 | B. | 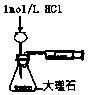 测定反应速率 | ||
| C. | 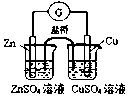 实现化学能转换为电能 | D. | 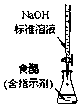 测定食醋浓度 |
分析 A.图中缺少搅拌器;
B.气体可从长颈漏斗逸出;
C.可构成Cu、Zn原电池;
D.图中为酸式滴定管.
解答 解:A.测定中和热时,为充分反应,应用环形玻璃棒搅拌,故A错误;
B.气体从长颈漏斗逸出,应用分液漏斗,故B错误;
C.锌为负极,铜为正极,能进行自发进行的氧化还原反应,可形成原电池,故C正确;
D.氢氧化钠可腐蚀玻璃,应用碱式滴定管,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握中和热测定、原电池、反应速率测定、中和滴定及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g):下列说法不正确的是( )
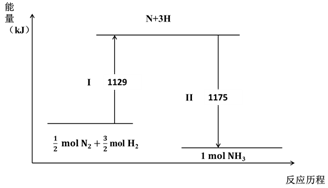

| A. | Ⅰ过程中破坏的均为非极性键 | |
| B. | Ⅰ过程吸收能量,II过程放出能量 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-44 kJ•mol-1 | |
| D. | 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高 |
8.工业上可用金属钠和氯化钾反应制备金属钾,其化学方程式为:Na+KCl$\frac{\underline{\;高温\;}}{\;}$NaCl+K↑.该反应属于( )
| A. | 置换反应 | B. | 复分解反应 | C. | 分解反应 | D. | 化合反应 |
2.将 SO2通入足量 Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应如下:①SO2+2Fe3++2H2O→SO42-+2Fe2++W,②Cr2O72-+aFe2++1bH+→Cr3++Fe3++H2O.下列有关说法正确的是( )
| A. | 还原性:Cr3+>SO2 | |
| B. | 方程式②中,a=6,b=7 | |
| C. | Cr2O72-能将Na2SO3 氧化成 Na2SO4 | |
| D. | 方程式①中 W 为 OH- |
9.A、B、C、D、E五种短周期主族元素,原子序数依次增大,其中A元素的某种原子无中子,D2-与E+电子层结构相同,B的最外层电子数是电子层数的两倍.下列说法正确的是( )
| A. | 原子半径:E>D>C>B>A | |
| B. | B、C、D与A形成的化合物中,D的化合物沸点一定最高 | |
| C. | A与B、C、D、E形成的化合物中A的化合价均为+1价 | |
| D. | A、B、C、D四种元素形成的某种离子化合物与酸和碱反应都可能放出气体 |
6.在一定条件下,不能由两种单质直接化合而成的化合物是( )
| A. | CO2 | B. | NO2 | C. | H2O | D. | HCl |
7.以下十种物质:
①铜 ②CH3COOH ③盐酸 ④二氧化碳 ⑤氢氧化铁胶体 ⑥CuSO4.5H2O
⑦熔融态氢氧化钠 ⑧碳酸钙 ⑨漂白粉 ⑩Cu(OH)2固体,按照表中提示的信息,把他们中符合左栏条件的物质的代号填入表格相应的位置.
①铜 ②CH3COOH ③盐酸 ④二氧化碳 ⑤氢氧化铁胶体 ⑥CuSO4.5H2O
⑦熔融态氢氧化钠 ⑧碳酸钙 ⑨漂白粉 ⑩Cu(OH)2固体,按照表中提示的信息,把他们中符合左栏条件的物质的代号填入表格相应的位置.
| 符合的条件 | 物质的代号 |
| 混合物 | |
| 可以导电的物质 | |
| 非电解质 | |
| 既不是电解质,也不是非电解质 | |
| 强电解质 | |
| 弱电解质 |