题目内容
12.(1)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g)+O2(g)?2SO3(g)△H<0,若此反应起始的物质的量相同,则如图关系图正确的是bd.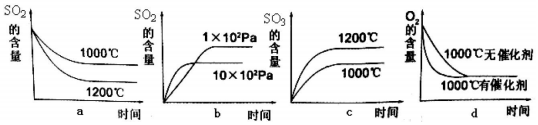
(2)实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是催化剂的活性较高、加快反应速率.
分析 (1)a.该反应为放热反应,升高温度,反应速率加快,平衡逆向移动;
b.该反应为气体体积减小的反应,压强越大,反应速率越快,平衡正向移动;
c.升高温度,反应速率加快,平衡逆向移动;
d.催化剂对平衡移动无影响,可加快反应速率;
(2)500℃与催化剂的活性、反应速率有关.
解答 解:(1)a.该反应为放热反应,升高温度,反应速率加快,平衡逆向移动,则温度高时SO2的含量大,图中不符,故不选;
b.该反应为气体体积减小的反应,压强越大,反应速率越快,平衡正向移动,与图象一致,故选;
c.升高温度,反应速率加快,平衡逆向移动,则温度高时SO3的含量小,图中不符,故不选;
d.催化剂对平衡移动无影响,可加快反应速率,与图象一致,故选;
故答案为:bd;
(2)实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是催化剂的活性较高、加快反应速率,
故答案为:催化剂的活性较高、加快反应速率.
点评 本题考查化学平衡移动,为高频考点,把握平衡移动原理与图象、实际生产中的应用为解答本题的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列物质间的转化不能通过一步反应实现的是( )
| A. | SiO2→H2SiO3 | B. | HClO→O2 | C. | Fe→FeCl2 | D. | Cu→CuSO4 |
3.不可能使溴水褪色的是( )
| A. | 己烯 | B. | 氢氧化钾溶液 | C. | 二氧化硫 | D. | 己烷 |
7.下列关于晶格能的说法中正确的是( )
| A. | 晶格能指形成1mol离子键所放出的能量 | |
| B. | 晶格能指破坏1mol离子键所吸收的能量 | |
| C. | 晶格能指1mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量 | |
| D. | 晶格能的大小与晶体的熔点,硬度无关 |
17.下列实验装置选择正确,能达到目的是( )
| A. | 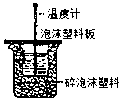 测定酸碱反应中和热 | B. | 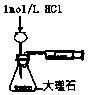 测定反应速率 | ||
| C. | 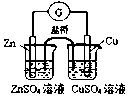 实现化学能转换为电能 | D. | 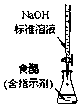 测定食醋浓度 |
2.下列现象或应用与胶体性质无关的是( )
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 一只钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 | |
| C. | FeCl3溶液加入NaOH溶液产生红褐色沉淀 | |
| D. | 水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染 |