题目内容
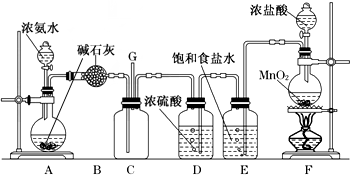
14.Cl2是一种有毒气体,如果泄漏会造成严重的危害.(1)已知:3Cl2+8NH3═6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏.当有少量Cl2泄漏,可以观察到的现象是出现白烟.
(2)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害.Cl2和石灰乳反应的化学方程式是2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(3)实验室常用烧碱溶液吸收Cl2.若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液.当NaCl和NaClO3的物质的量之比为8:1时,混合液中NaClO和NaClO3的物质的量之比为3:1.
分析 (1)根据反应3Cl2+8NH3═6NH4Cl+N2结合产物回答实验现象;
(2)氯气可以和强碱氢氧化钙之间反应生成氯化钙、次氯酸钙和水,据此书写方程式;
(3)根据氧化还原反应中电子守恒以及元素守恒来计算即可.
解答 解:(1)根据反应3Cl2+8NH3═6NH4Cl+N2,会看到的实验现象是出现白烟,故答案为:出现白烟;
(2)氯气可以和强碱氢氧化钙之间反应生成氯化钙、次氯酸钙和水,方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液.过程中氯气既是氧化剂又是还原剂,当NaCl和NaClO3的物质的量之比为8:1时,Cl原子失电子是5mol,的电子是8mol,所以NaClO的物质的量是3mol,混合液中NaClO和NaClO3的物质的量之比为3:1,故答案为:3:1.
点评 本题考查学生物质的性质以及氧化还原反应中电子守恒的计算知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
4.根据碳原子的成键特点,甲烷分子中形成共价键的数目为( )
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
5.下列有关金属及其化合物的说法正确的是( )
| A. | Na暴露于空气中最终生成Na2O2 | |
| B. | 铜粉能溶于酸性硝酸钠溶解 | |
| C. | Fe比Al更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉会有红棕色固体生成 |
2.常温下,下列各组离子在指定溶液中,一定可以大量共存的是( )
| A. | 无色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
9.下列技术应用中,其工作原理不涉及化学反应的是( )
| A. |  火炬燃烧 | B. |  风力发电 | C. |  粮食酿醋 | D. |  高炉炼铁 |
6.下列物质不属于高分子化合物的是( )
| A. | 油脂 | B. | 羊毛 | C. | 淀粉 | D. | 橡胶 |
4.化学与人类的生产、生活密切相关,下列说法正确的是( )
| A. | 在空气中,钢铁制品和铝制品都容易发生吸氧腐蚀 | |
| B. | 聚乙烯塑料易老化,是因为发生了加成反应 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 空气质量指标中有一项指标名称为PM2.5,指的是空气中直径≤2.5微米的固体或液体的总称 |