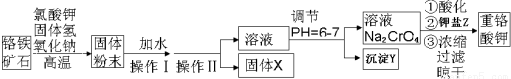
��Ŀ����
19��ijͬѧ������ʵ��| ʵ�� | 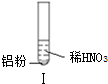 | 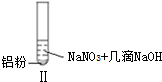 | 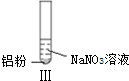 |
| ���� | ��Һ��ɫ���Թ��Ϸ� �ʺ���ɫ | �����������ݣ���ʹʪ��� ɫʯ����ֽ���� | �������ݣ���ʹʪ���ɫʯ����ֽ���� |
| A�� | ʵ����Թ��Ϸ����ֺ���ɫ��ԭ���ǣ�2NO+O2=2NO2 | |
| B�� | ����ʵ���������������˵������NH3���� | |
| C�� | ʵ�����Һ�з����ķ�Ӧ�ǣ�Al+6H++3NO3-=Al3++3NO2��+3H2O | |
| D�� | ��ʵ����У�NO3-���ᡢ�������Һ�ж�����ԭ |
���� A��NO����ɫ���塢���������Ǻ���ɫ���壻
B����ʹʪ��ĺ�ɫʯ����ֽ����ɫ�������ǰ�����
C��Al��ϡ���ᷴӦ����NO��
D��I������NO��II��III�����ɰ�����
��� �⣺A��NO����ɫ���塢���������Ǻ���ɫ���壬Al��ϡ���ᷴӦ������ɫ��NO��NO���ȶ����ױ������������ɺ���ɫ�������������������Ӧ2NO+O2=2NO2����A��ȷ��
B����ʹʪ��ĺ�ɫʯ����ֽ����ɫ�������ǰ���������ʵ�������������������֪��˵��II��III����NH3��������B��ȷ��
C��Al��ϡ���ᷴӦ����NO�������ӷ���ʽΪAl+4H++NO3-=Al3++NO��+2H2O����C����
D��I������NO��II��III�����ɰ�����I����Һ�����Զ�II��III��Һ�ʼ��ԣ�����ʵ����У�NO3-���ᡢ�������Һ�ж�����ԭ����D��ȷ��
��ѡC��
���� ���⿼�黯ѧʵ�鷽�����ۣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������жϼ��ܽ������������ȷʵ��ԭ�������������ǽⱾ��ؼ���ע�⣺����Ũ���ᷢ���ۻ�����ϡ���ᷴӦ������������NO����Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
9���������ʼ��ÿ��ת��ͨ��һ����Ӧ����ʵ�ֵ��ǣ�������
| A�� | N2��NO2��HNO3 | B�� | Fe��FeCl3��FeCl2 | ||
| C�� | S��SO3��Na2SO4 | D�� | Al2O3��Al��OH��3��NaAlO2 |
10���������ӷ���ʽ��д��ȷ���ǣ�������
| A�� | �ã�NH4��2Fe��SO4��2 ��Һ�����NaOH��Ӧ��Fe��OH��2��Fe2++2OH-=Fe��OH��2�� | |
| B�� | ��ϡ�������Һ��ȥ����Ʒ��������⣺Fe2O3+6H+=2Fe3++3H2O | |
| C�� | ��С�մ���Һ�м�������Ca��OH��2��Һ��Ӧ��Ca2++2OH-+2HCO3-=CaCO3��+2H2O+CO32- | |
| D�� | ��NaClO��Һ�е�������FeSO4��Һ����Ӧ�����ӷ���ʽΪ��2Fe2++ClO-+2H+�TCl-+2Fe3++H2O |
14��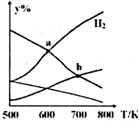 ��CO2��H2Ϊԭ����ȡ�Ҵ��ķ�ӦΪ��2CO2��g��+6H2��g���TCH3CH2OH��g��+3H2O��g����H��0��ijѹǿ�µ��ܱ������У���CO2��H2�����ʵ�����Ϊ1��3Ͷ�ϣ���ͬ�¶��£��ﵽƽ���ƽ����ϵ�и����ʵ����ʵ���������y%�����¶ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������
��CO2��H2Ϊԭ����ȡ�Ҵ��ķ�ӦΪ��2CO2��g��+6H2��g���TCH3CH2OH��g��+3H2O��g����H��0��ijѹǿ�µ��ܱ������У���CO2��H2�����ʵ�����Ϊ1��3Ͷ�ϣ���ͬ�¶��£��ﵽƽ���ƽ����ϵ�и����ʵ����ʵ���������y%�����¶ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������
 ��CO2��H2Ϊԭ����ȡ�Ҵ��ķ�ӦΪ��2CO2��g��+6H2��g���TCH3CH2OH��g��+3H2O��g����H��0��ijѹǿ�µ��ܱ������У���CO2��H2�����ʵ�����Ϊ1��3Ͷ�ϣ���ͬ�¶��£��ﵽƽ���ƽ����ϵ�и����ʵ����ʵ���������y%�����¶ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������
��CO2��H2Ϊԭ����ȡ�Ҵ��ķ�ӦΪ��2CO2��g��+6H2��g���TCH3CH2OH��g��+3H2O��g����H��0��ijѹǿ�µ��ܱ������У���CO2��H2�����ʵ�����Ϊ1��3Ͷ�ϣ���ͬ�¶��£��ﵽƽ���ƽ����ϵ�и����ʵ����ʵ���������y%�����¶ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | a���ƽ�ⳣ��С��b�� | B�� | b�㣺v����CO2��=v����H2O�� | ||
| C�� | a�㣺n��H2��=n��H2O�� | D�� | �¶Ȳ��䣬�������H2��D��CO2������ |
8������Ǧ������Ǧ���ء���ά���ؼ���Ϳ�Ϸ����Լ�����ҵ��ͨ������Ȼ��ֲ����ķ�Ǧ����Ҫ�ɷ�ΪPbS����������Ǧ�������������£�
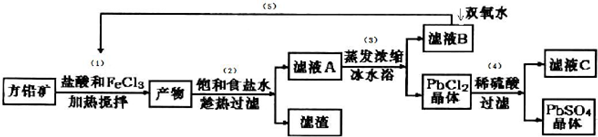
��֪����Ksp��PbSO4��=1.08��10-8��Ksp��PbCl2��=1.6��l0-5��
��PbCl2��s��+2C1-��aq��?PbCl42-��aq����H��0
��Fe3+��Pb2+������������ʽ��ʼ����ʱ��PHֵ�ֱ�Ϊ1.9��7��
��I �������м���������Կ�����Һ��pH��1.9����ҪĿ��������Fe3+��ˮ�⣮��Ӧ�����пɹ۲쵽����ɫ���������裨1����Ӧ����Ҫ��Ӧ�����ӷ���ʽΪ2Fe3++PbS=PbCl2+S+2Fe2+��
��II�� ���裨2�����õ���ҺA ����Ũ�������ñ�ˮԡ��Ŀ�����ñ�ˮԡʹPbCl2��s��+2Cl-��aq��?PbCl4-��H��0�����ƶ���ʹPbCl4-ת��PbCl2����������ƽ���ƶ�ԭ�����ͣ�
��III �����������п�ѭ�����õ�������FeCl3��HCl��
��IV����Ǧ����Ǧ����ʹˮ�����ؽ���Ǧ�ĺ�����������������Ⱦ��ˮ��Һ��Ǧ�Ĵ�����̬��Ҫ��
Pb2+��Pb��OH��+��Pb��OH��2��Pb��OH��3-��Pb��OH��42-������̬��ǦŨ�ȷ���������ҺpH �仯�Ĺ�ϵ��ͼ��ʾ��

��̽��Pb2+�����ʣ���Pb2+����Һ����εμ�NaOH����Һ����ǣ������μ�NaOH��Һ�ֱ���壻pH��13ʱ����Һ�з�������Ҫ��Ӧ�����ӷ���ʽΪPb��OH��3-+HO-=Pb��OH��42-����
�ڳ�ȥ��Һ�е�Pb2+������С����һ�������Լ���ȥ��ˮ�еĺ���Ǧ�������������ӣ�ʵ������¼���£�
���ɱ���֪���Լ�ȥ��Pb2+��Ч����ã����ϱ����й�����˵��ȥ��Pb2+��Fe3+Ч���õ������Ǽ����Լ���Pb2+��Ũ��ת����Ϊ$\frac{��0.1-0.004��}{0.1}$��1005%=96%��Fe3+��Ũ��ת����Ϊ$\frac{0.12-0.04}{0.12}$��100%=67%������ȥ��Pb2+��Fe3+Ч���ã�
���������Լ���DH������Ǧ��������Ҫ�����ķ�ӦΪ��2DH��s��+Pb2+?D2Pb��s��+2H+������Ǧʱ����ʵ�pHԼΪB��
A��4 B��6 C�� 10 D�� 12��

��֪����Ksp��PbSO4��=1.08��10-8��Ksp��PbCl2��=1.6��l0-5��
��PbCl2��s��+2C1-��aq��?PbCl42-��aq����H��0
��Fe3+��Pb2+������������ʽ��ʼ����ʱ��PHֵ�ֱ�Ϊ1.9��7��
��I �������м���������Կ�����Һ��pH��1.9����ҪĿ��������Fe3+��ˮ�⣮��Ӧ�����пɹ۲쵽����ɫ���������裨1����Ӧ����Ҫ��Ӧ�����ӷ���ʽΪ2Fe3++PbS=PbCl2+S+2Fe2+��
��II�� ���裨2�����õ���ҺA ����Ũ�������ñ�ˮԡ��Ŀ�����ñ�ˮԡʹPbCl2��s��+2Cl-��aq��?PbCl4-��H��0�����ƶ���ʹPbCl4-ת��PbCl2����������ƽ���ƶ�ԭ�����ͣ�
��III �����������п�ѭ�����õ�������FeCl3��HCl��
��IV����Ǧ����Ǧ����ʹˮ�����ؽ���Ǧ�ĺ�����������������Ⱦ��ˮ��Һ��Ǧ�Ĵ�����̬��Ҫ��
Pb2+��Pb��OH��+��Pb��OH��2��Pb��OH��3-��Pb��OH��42-������̬��ǦŨ�ȷ���������ҺpH �仯�Ĺ�ϵ��ͼ��ʾ��

��̽��Pb2+�����ʣ���Pb2+����Һ����εμ�NaOH����Һ����ǣ������μ�NaOH��Һ�ֱ���壻pH��13ʱ����Һ�з�������Ҫ��Ӧ�����ӷ���ʽΪPb��OH��3-+HO-=Pb��OH��42-����
�ڳ�ȥ��Һ�е�Pb2+������С����һ�������Լ���ȥ��ˮ�еĺ���Ǧ�������������ӣ�ʵ������¼���£�
| ���� | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| ����ǰŨ��/��mg•L-1�� | 0.100 | 29.8 | 0.12 | 0.087 |
| ������Ũ��/��mg•L-1�� | 0.004 | 22.6 | 0.04 | 0.053 |
���������Լ���DH������Ǧ��������Ҫ�����ķ�ӦΪ��2DH��s��+Pb2+?D2Pb��s��+2H+������Ǧʱ����ʵ�pHԼΪB��
A��4 B��6 C�� 10 D�� 12��
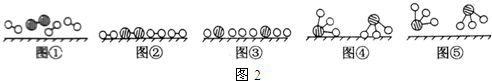
 ��
�� ��
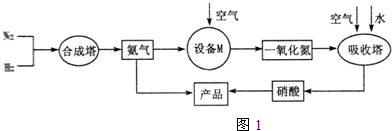
��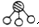 �ֱ��ʾN2��H2��NH3��ͼ�ݱ�ʾ���ɵ�NH3�뿪�������棬ͼ�ں�ͼ�۵ĺ���ֱ���N2��H2�������ڴ������桢�ڴ�������N2��H2�еĻ�ѧ�����ѣ�
�ֱ��ʾN2��H2��NH3��ͼ�ݱ�ʾ���ɵ�NH3�뿪�������棬ͼ�ں�ͼ�۵ĺ���ֱ���N2��H2�������ڴ������桢�ڴ�������N2��H2�еĻ�ѧ�����ѣ� �������ʹ���������������õ���Ҫ�о�����
�������ʹ���������������õ���Ҫ�о�����