题目内容
9.以下物质间的每步转化通过一步反应就能实现的是( )| A. | N2→NO2→HNO3 | B. | Fe→FeCl3→FeCl2 | ||
| C. | S→SO3→Na2SO4 | D. | Al2O3→Al(OH)3→NaAlO2 |
分析 A.碳酸氢钠加热或与酸反应生成二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;
B.铁与氯气反应生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁;
C.硫不能一步反应生成三氧化硫;
D.氧化铝不能与水反应生成氢氧化铝.
解答 解:A.氮气不能一步反应生成二氧化氮,转化通过一步反应不能实现,故A错误;
B.铁与氯气反应生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁,每步转化通过一步反应就能实现,故B正确;
C.S→SO3的转化不能一步实现,可以先与氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,故C错误;
D.氧化铝不能与水反应生成氢氧化铝,Al2O3→Al(OH)3的转化,可以向与酸反应生成铝盐,铝盐与碱反应生成氢氧化铝沉淀,故D错误;
故选B.
点评 本题考查元素化合物物质之间的转化等,比较基础,掌握物质的性质是解答本题的关键,注意基础知识的积累掌握,题目较简单.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
19.下列溶液不能区别SO2和CO2气体的( )
| A. | 稀盐酸 | B. | 品红溶液 | C. | 酸性高锰酸钾 | D. | 溴水 |
20.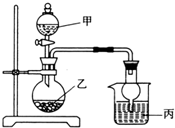 用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( )
用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( )
 用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( )
用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( ) | 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | H2O2 | MnO2 | FeCl2溶液 | 溶液由浅绿色变为棕黄色 |
| B | 浓氨水 | CaO | AgNO3溶液 | 有白色沉淀生成 |
| C | H2SO4 | Na2SO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓HNO3 | Cu | NaHCO3溶液 | 有无色气体生成 |
| A. | A | B. | B | C. | C | D. | D |
17.以下能说明氯的非金属性比硫强的事实是( )
| A. | 氯的最高价为+7价而硫的最高价为+6价 | |
| B. | HCl的酸性比H2S的酸性强 | |
| C. | H2S能被Cl2氧化成硫单质 | |
| D. | HClO的氧化性比H2SO4的氧化性强 |
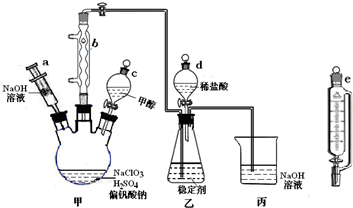
18.二氧化氯气体有毒,常应用在果蔬保鲜等方面.用NaClO3与CH3OH(沸点64.7℃)在催化剂、60℃时,发生反应得到ClO2,实验装置如图(已知ClO2的稳定性较差,用稳定剂吸收ClO2,使用时加酸释放出ClO2).
完成下列填空:
(1)仪器b的名称为球形冷凝管,其作用是冷凝回流甲醇.
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式4NaClO3+CH3OH+2H2SO4$\frac{\underline{\;催化剂\;}}{△}$4ClO2↑+HCOOH+2Na2SO4+3H2O.
(3)甲装置中采取的加热方式是水浴加热;如果滴加甲醇的速度过快,可能造成的后果反应速率过快,反应生成的ClO2来不及被稳定剂吸收.
(4)某同学建议将上述装置中的分液漏斗c改用恒压漏斗e,你认为他的理由是有利于液体顺利流下,减少甲醇的挥发.
(5)实验结束后,先用仪器a注入一定量的NaOH,过一段时间后再拆卸仪器,其目的是使反应停止,并吸收ClO2.
(6)如表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是2,原因是稳定剂2释放ClO2的浓度稳定,保鲜时间更长.
(7)某同学在实验室测定某保鲜剂中ClO2的含量,其实验操作如下:
在锥形瓶中加入足量的KI溶液,再加入5mL稀硫酸;取15mL保鲜剂于锥形瓶中,ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;用0.100mol•L-1 Na2S2O3标准溶液滴定碘单质(I2+2S2O32-═2I-+S4O62-),达到滴定终点时用去18.00mL Na2S2O3标准溶液.测得该保鲜剂中ClO2的含量为1.62 g•L-1.

完成下列填空:
(1)仪器b的名称为球形冷凝管,其作用是冷凝回流甲醇.
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式4NaClO3+CH3OH+2H2SO4$\frac{\underline{\;催化剂\;}}{△}$4ClO2↑+HCOOH+2Na2SO4+3H2O.
(3)甲装置中采取的加热方式是水浴加热;如果滴加甲醇的速度过快,可能造成的后果反应速率过快,反应生成的ClO2来不及被稳定剂吸收.
(4)某同学建议将上述装置中的分液漏斗c改用恒压漏斗e,你认为他的理由是有利于液体顺利流下,减少甲醇的挥发.
(5)实验结束后,先用仪器a注入一定量的NaOH,过一段时间后再拆卸仪器,其目的是使反应停止,并吸收ClO2.
(6)如表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是2,原因是稳定剂2释放ClO2的浓度稳定,保鲜时间更长.
| 时间 稳定剂 | 0天 | 2天 | 4天 | 6天 | 8天 | 10天 | 12天 | 14天 | 16天 |
| 稳定剂1浓度 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
| 稳定剂2浓度 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
在锥形瓶中加入足量的KI溶液,再加入5mL稀硫酸;取15mL保鲜剂于锥形瓶中,ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;用0.100mol•L-1 Na2S2O3标准溶液滴定碘单质(I2+2S2O32-═2I-+S4O62-),达到滴定终点时用去18.00mL Na2S2O3标准溶液.测得该保鲜剂中ClO2的含量为1.62 g•L-1.
19.某同学做如下实验
下列说法不正确的是( )
| 实验 | 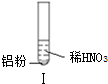 | 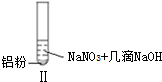 | 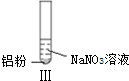 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
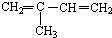 与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br.
与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br. .
. CH3COOC2H5+H2O
CH3COOC2H5+H2O ;
;