题目内容
4. 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和BH4反应制得.
①Ti的基态原子外围电子排布式为3d24s2.
②LiBH4由Li+和BH4-构成,BH4-的空间构型是正四面体,BH4-中B原子的杂化类型为sp3,LiBH4中存在的作用力有离子键、共价键和配位键.
③LiBH4元素的电负性由大到小排列顺序为H>B>Li.
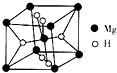
(2)MgH2也是一种储氢材料,其晶胞结构如图所示.
已知该晶胞的体积为V cm3,则该晶体的密度为$\frac{52}{V{N}_{A}}$g/cm3[用V、NA表示(其中NA为阿伏加德罗常数的值)].MgH2要密封保存,通水会缓慢反应.反应的化学方程式为MgH2+H2O=Mg(OH)2↓+H2↑.
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为12,空间利用率为74%.一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氧后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为Cu3AuH8.
分析 (1)①Ti元素为22号元素,原子核外有22个电子,其3d、4s能级电子为其价电子,根据核外电子排布规律书写;
②根据价层电子对互斥理论确定离子空间构型、原子杂化方式,阴阳离子之间存在离子键,非金属元素之间存在共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键;
③元素的非金属性越强,其电负性越大;
(2)该晶胞中Mg原子=8×$\frac{1}{8}$+1=2,H原子个数=2+4×$\frac{1}{2}$=4,其密度=$\frac{m}{V}$;MgH2和水反应生成氢氧化镁和氢气;
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为12,空间利用率为74%,该晶胞中Au原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H.
解答 解:(1)①Ti的原子序数为22,原子核外有22个电子,其3d、4s能级电子为其价电子,根据原子核外电子排布规律知,其价电子排布式为3d24s2,
故答案为:3d24s2;
②BH4-中B原子价层电子数=4+$\frac{3+1-4×1}{2}$=4,且不含孤电子对,所以是正四面体构型,B原子采用sp3杂化,Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键,
故答案为:正四面体;sp3;离子键、共价键和配位键;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)该晶胞中Mg原子=8×$\frac{1}{8}$+1=2,H原子个数=2+4×$\frac{1}{2}$=4,其密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×2}{V}$=$\frac{\frac{26}{{N}_{A}}×2}{V}$g/cm3=$\frac{52}{V{N}_{A}}$g/cm3;MgH2和水反应生成氢氧化镁和氢气,反应方程式为MgH2+H2O=Mg(OH)2↓+H2↑,
故答案为:$\frac{52}{V{N}_{A}}$g/cm3;MgH2+H2O=Mg(OH)2↓+H2↑;
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为12,空间利用率为74%,该晶胞中Au原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
故答案为:12;74%;Cu3AuH8.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、元素周期律判断、原子核外电子排布等知识点,侧重考查学生分析计算能力,注意晶胞计算中均摊法的应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 蛋白质的变性 | B. | 蛋白质的盐析 | C. | 胶体聚沉 | D. | 盐类水解 |

(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如表:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2之间存在反应N2O4(g)?2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率,[aN2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),若要提高N2O4的转化率,除改变反应温度外,其它措施有减小体系压强、移出NO2(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强P0为108kPa,列式计算该温度下反应的平衡常数.Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数.相应的速率-压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点.
(3)某科研人员设计如图3甲所示新型燃料电池,已知固体电解质可以传导O2-,生成物均为无毒无害的物质.将燃料电池的正负两极与装置乙中M、N两惰性电极连接,两极室均可产生乙醛酸(HOOC-CHO).其中M电极区的乙二醛(OHC-CHO)与电极产物发生反应生成乙醛酸.则:
①燃料电池负极的电极反应式为N2H4+2O2-4e-=N2+2H2O.
②a极与N(填“M”或“N”)相连,写出N极电极反应式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
③若有1.5mol H+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1.5mol.
| 实验 | 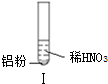 | 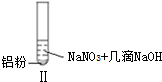 | 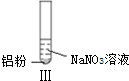 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
| A. | 在FeO•FeyCrxO3中3x=y | |
| B. | 消耗硫酸亚铁铵的物质量为n(2-x)mol | |
| C. | 反应中发生转移的电子数为3nx mol | |
| D. | 处理废水中Cr2O72- 的物质量为$\frac{nx}{2}$mol |
| A. | CO | B. | NH3 | C. | Cl2 | D. | N2 |
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2L乙醇蒸气含共价键数目为4NA | |
| C. | 1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L0.2mol•L-1NH4ClO4溶液中含NH4+数目为0.2NA |