题目内容
7.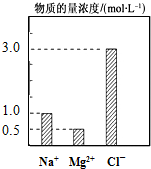 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:(1)该混合液中,NaCl的物质的量的浓度为1.0mol•L-1,含溶质MgCl2的物质的量为0.1mol.
(2)该混合液中KCl的质量为14.9g.
分析 (1)根据图象中镁离子、钠离子的浓度可以得出氯化钠、氯化镁的物质的量浓度;然后根据n=cV计算出氯化镁的物质的量;
(2)根据电荷守恒计算出钾离子的浓度,然后根据n=cV计算出氯化钾的物质的量,再根据m=nM计算出氯化钾的质量.
解答 解:(1)根据图象可知,Na+的物质的量浓度为1.0mol/L,则该混合液中,NaCl的物质的量的浓度为1.0mol•L-1;
同理,Mg2+的物质的量浓度为0.5mol/L,则MgCl2的物质的量浓度为0.5mol/L,含溶质MgCl2的物质的量为:0.5mol/L×0.2L=0.1mol,
故答案为:1.0;0.1;
(2)根据溶液呈电中性,则c(K+)+2c(Mg2+)+c(Na+)=c(Cl-),则c(K+)=3.0-1.0-0.5×2=1.0 mol/L,
所以该混合液中KCl的质量为:1.0mol/L×0.2L×74.5g/mol=14.9g,
故答案为:14.9.
点评 本题考查物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.将质量为24.6g的铝、铜合金加入到1000mL的稀硝酸中,固体完全溶解,收集到的还原产物全是NO,标准状况下的体积为8.96L,向所得溶液中加入物质的量浓度为4mol/L NaOH溶液至沉淀质量最大时所用体积为400mL,则下列有关叙述中不正确的是( )
| A. | 被还原的硝酸的物质的量为0.4mol | |
| B. | 测得生成沉淀的质量比原合金的质量增加20.4g | |
| C. | 原硝酸的浓度为1.6 mol/L | |
| D. | 合金中铝的质量为5.4g |
15.某非金属元素在化学反应中从化合态变为游离态,则该元素( )
| A. | 一定被氧化 | B. | 一定被还原 | ||
| C. | 可能被氧化,也可能被还原 | D. | 化合价升高为O |
12.下列说法不正确的是( )
| A. | 天然橡胶、聚氯乙烯的链节中均含有两种官能团 | |
| B. | 氯气易液化,可用钢瓶储存液氯 | |
| C. | 工业酒精的浓度通常为95% | |
| D. | 向某溶液加入CCl4,若CCl4层显橙红色,证明原溶液中存在Br2 |
16.下列离子方程式正确的是( )
| A. | HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | |
| C. | 过量的CO2通入NaOH溶液中:CO2-+2OH-=CO32-+H2O | |
| D. | 新制氢氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O↓+2H2O |
17.在下列物质中,化学键类型完全相同的一组是( )
| A. | CO2和H2O | B. | NaCl和HCl | C. | CCl4和KCl | D. | Mg(OH)2和SO2 |
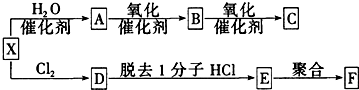
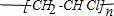 .
.
 ;D分子的空间构型为V型.
;D分子的空间构型为V型.