题目内容
19.有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现进行以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成
②向①的悬浊液中加入过量的稀硝酸,白色沉淀消失并有气泡产生
③取少量②的溶液滴入稀硫酸,有白色沉淀生成
④另取少量②的溶液,滴入硝酸银溶液,有白色沉淀生成
(1)根据上述实验现象,判断白色粉末的组成成分是:氯化钙、碳酸钾,可能含硝酸钡(写名称)
(2)写出步骤①和③有关反应的化学方程式:K2CO3+CaCl2=CaCO3↓+2KCl(可能发生K2CO3+Ba(NO3)2=BaCO3↓+2KNO3)、Ca(NO3)2+H2SO4=2HNO3+CaSO4↓[可能发生Ba(NO3)2+H2SO4=2HNO3+BaSO4↓].
分析 由①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀为碳酸钡或碳酸钙,则一定含K2CO3;
②向①的悬浊液中加入过量的稀硝酸,白色沉淀消失并有气泡产生,气体为二氧化碳;
③取少量②的溶液滴入稀硫酸,有白色沉淀生成,白色沉淀为硫酸钡或硫酸钙,
④另取少量②的溶液,滴入硝酸银溶液,有白色沉淀生成,白色沉淀为AgCl,则原粉末含CaCl2,以此来解答.
解答 解:由①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀为碳酸钡或碳酸钙,则一定含K2CO3;
②向①的悬浊液中加入过量的稀硝酸,白色沉淀消失并有气泡产生,气体为二氧化碳;
③取少量②的溶液滴入稀硫酸,有白色沉淀生成,白色沉淀为硫酸钡或硫酸钙,
④另取少量②的溶液,滴入硝酸银溶液,有白色沉淀生成,白色沉淀为AgCl,则原粉末含CaCl2,
综上所述,白色粉末一定含CaCl2、K2CO3,可能含Ba(NO3)2,
(1)由上述实验现象,白色粉末的组成成分是氯化钙、碳酸钾,可能含硝酸钡,
故答案为:氯化钙、碳酸钾,可能含硝酸钡;
(2)步骤①发生反应的化学方程式为K2CO3+CaCl2=CaCO3↓+2KCl(可能发生K2CO3+Ba(NO3)2=BaCO3↓+2KNO3),
③中有关反应的化学方程式为Ca(NO3)2+H2SO4=2HNO3+CaSO4↓[可能发生Ba(NO3)2+H2SO4=2HNO3+BaSO4↓],
故答案为:K2CO3+CaCl2=CaCO3↓+2KCl(可能发生K2CO3+Ba(NO3)2=BaCO3↓+2KNO3)、Ca(NO3)2+H2SO4=2HNO3+CaSO4↓[可能发生Ba(NO3)2+H2SO4=2HNO3+BaSO4↓].
点评 本题考查无机物的推断,为高频考点,把握白色沉淀的成分为解答的关键,侧重分析与推断能力的考查,注意硝酸钡不能确定,题目难度不大.

| A. | 将氯化铝溶液滴入浓氢氧化钠溶液中,立刻产生大量白色沉淀 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | A1Cl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 常温下,Al(OH)3既能与NaOH溶液反应又能与稀硫酸反应 |
| A. | 组成上一个或若干个CH2原子团,且符合同一通式的有机物互称为同系物 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 苯的邻位二元取代物只有一种说明苯环中不存在单双键交替 | |
| D. | CH3-CH3+Cl2→CH2ClCH2Cl的反应类型为加成反应 |
| A. | 22a | B. | 44a | C. | $\frac{44a}{3}$ | D. | 14a |
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
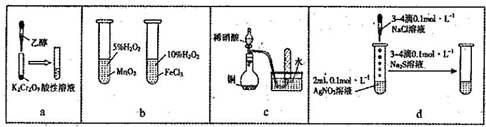
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,右边试管中产生气泡较为迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图,根据试管中收集到无色气体,不能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
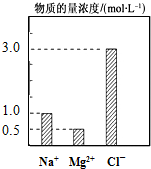 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题: