题目内容
9.下列解释实验事实的平衡不正确的是( )| 实验 | 解释 | |
| A | 100℃0.1mol/L Na2SO4溶液pH=6.2 | H2O=H++OH- |
| B | 0.1mol/L CH3COOH的pH=3 | CH3COOH?CH3COO-+H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O?Fe(OH)3+3H+ |
| D | 随温度有升高,碳酸钠溶液pH增大 | CO32-+2H2O?H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水的电离吸热,升高温度促进水电离;
B.醋酸是弱电解质,在水溶液中存在电离平衡;
C.氯化铁易水解生成氢氧化铁和HCl,加入稀盐酸抑制铁离子水解;
D.硫酸钡在水溶液里存在电离平衡,硫酸根离子抑制硫酸钡电离.
解答 解:A.水的电离吸热,水存在电离平衡,升高温度促进水电离,导致中性溶液的pH小于7,所以100℃0.1mol/L Na2SO4溶液pH=6.2,故A正确;
B.醋酸是弱电解质,在水溶液中部分电离导致溶液中氢离子浓度小于醋酸浓度,即溶液中存在电离平衡,故B正确;
C.氯化铁易水解生成氢氧化铁和HCl,加入稀盐酸抑制铁离子水解,Fe3++3H2O?Fe(OH)3+3H+,故C正确;
D.碳酸钠溶液中碳酸根离子分步水解CO32-+H2O?HCO3-+OH-,升高温度,水解平衡正向移动,碱性增强,pH增大,故D错误;
故选D.
点评 本题考查了弱电解质的电离、盐类水解等知识点,根据外界条件对平衡的影响来分析解答,注意pH=7的溶液不一定是中性溶液,为易错点.

练习册系列答案
相关题目
20. 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,如表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H<0 (填“>”、“=”或“<”),此反应较低(填“较高”或“较低”)温度下有利于该反应自发进行.
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中:
请完成此实验条件A:150℃,D:5.
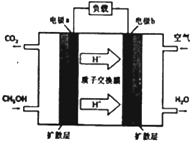
(2)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图:
①b电极为正 极,a电极的电极反应式为:H2O+CH3OH-6e-=CO2+6H+.
②当电池消耗22.4LO2(标况下)时,消耗的甲醇的质量为$\frac{64}{3}$g.
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,如表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中:
请完成此实验条件A:150℃,D:5.
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | A | B | D |
| 3 | 350 | C | 5 |
①b电极为正 极,a电极的电极反应式为:H2O+CH3OH-6e-=CO2+6H+.
②当电池消耗22.4LO2(标况下)时,消耗的甲醇的质量为$\frac{64}{3}$g.
17.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3; CKAl(SO4)2.
(2)写出过量E滴人到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(4)在A溶液中加入足量的澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3; CKAl(SO4)2.
(2)写出过量E滴人到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(4)在A溶液中加入足量的澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
4.下列物质属于电解质的是( )
| A. | 次氯酸 | B. | 浓硫酸 | C. | 氯水 | D. | 陶瓷 |
14.下列有关说法中,不正确的是( )
| A. | 煤干馏后的产物可以制造氮肥 | |
| B. | 可在周期表的过渡元素中寻找半导体材料 | |
| C. | 可用新制的氢氧化铜检验葡萄糖 | |
| D. | 可用氯气制备漂白粉 |
18.下列判断中正确的是( )
| A. | 可用澄清石灰水来区分二氧化碳和二氧化硫 | |
| B. | 用米汤检验食用加碘盐(含KIO3)中含有碘元素 | |
| C. | 能使灼热的CuO由黑变红的气体一定是H2 | |
| D. | 可用石蕊试液来鉴别盐酸和NaOH |

 ,写出B的化学式:Fe3O4,写出C的化学式:Al2O3,主要成分是J的矿石的名称:赤铁矿.
,写出B的化学式:Fe3O4,写出C的化学式:Al2O3,主要成分是J的矿石的名称:赤铁矿.